
【题目】在一定温度下的定容密闭容器中,下列说法不能表明反应A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.B的物质的量浓度 B.混合气体的压强不变
C.混合气体的密度 D.混合气体的相对分子质量不变
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的区别的叙述,正确的是( )
A.胶体带电荷,溶液不带电荷
B.溶液中通过一束光线时没有明显现象,胶体中通过一束光线时出现明显的光路
C.胶体微粒带电荷,溶液中溶质微粒不带电荷
D.在胶体中通电时,分散质微粒向某一极移动,在溶液中通电时,溶质微粒分别向两极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混合放入VL密闭容器中,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
(1)以B的浓度变化表示的该反应的速率为v (B)= 。
(2)该化学方程式中,各物质的化学计量数分别为:a b c d
(3)若只改变压强,反应速率变化但平衡状态不移动,则各物质的聚集状态分别是:A B D 。若在上述平衡混合物中再加入B物质,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.条件不够,无法判断
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是 ( )
A. 该物质有很高的熔点、很大的硬度 B. 该物质形成的晶体属于分子晶体
C. 该物质分子中Si60被包裹在C60里面 D. 该物质的相对分子质量为1200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明氢氟酸是弱酸的实验事实是
A.HF溶液与Zn反应放出H2
B.0.1mol/LNaF溶液的pH大于7
C.HF溶液与Na2CO3反应生成CO2
D.0.1mol/LHF溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已准确称量过的氯化钠固体配制1.00 mol·L-1的氯化钠溶液0.5 L,要用到的仪器是( )
①500 mL容量瓶 ②试管 ③烧瓶 ④胶头滴管 ⑤烧杯
⑥玻璃棒 ⑦托盘天平 ⑧药匙
A.①④⑤⑥
B.①②④⑤
C.①④⑤⑥⑦⑧
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用Cl2生产某些含氯有机物时会产生副产物HCl。
利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.![]()
![]()
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
(2)氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻对应的实验条件改变分别是t4 ;t5 ;t7 。
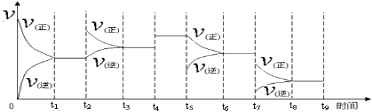
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则n= 。
(3)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(4)传统制备肼的方法是以NaClO氧化NH3,制得肼(N2H4)的稀溶液。该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com