
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产,回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出相应反应的化学方程式 。
(2)已知:
甲醇脱水反应 2CH3OH(g)═CH3OCH3(g) + H2O(g)△H1=﹣23.9kJmol﹣1
甲醇制烯烃反应 2CH3OH(g)═C2H4(g) + 2H2O(g)△H2=﹣29.1kJmol﹣1
乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=" +" 50.7kJmol﹣1
则乙烯气相直接水合反应C2H4(g) + H2O(g)═C2H5OH(g)的△H= kJmol﹣1,与间接水合法相比,气相直接水合法的优点是 ;
(3)气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中![]() :
:![]() =1:1)
=1:1)
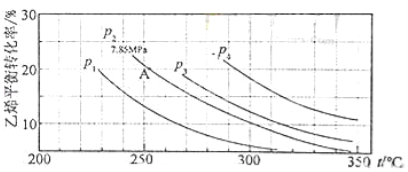
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= 。
(A点总压为7.85MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(P1,P2,P3,P4)大小顺序为 ,理由是 ;
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,![]() :
:![]() =0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
=0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
【答案】C2H4+ H2SO4=C2H5OSO3H、C2H5OSO3H + H2O→C2H5OH + H2SO4
﹣45.5 无副产品,原子利用率100% 0.07(MPa)﹣1 p1<p2<p3<p4 正反应为气体分子数减少的反应,相同温度下,压强升高,平衡向正方向移动,乙烯转化率提高
将产物乙醇液化移去、 增加n(H2O):n(C2H4)的比值
【解析】试题分析:(1)根据题意可得乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)的方程式为C2H4+ H2SO4= C2H5OSO3H,硫酸氢乙酯发生水解反应得到乙醇,方程式为C2H5OSO3H + H2O=C2H5OH + H2SO4;
(2)根据盖斯定律可知:化学反应放出的能量多少与反应途径无关,而只与物质的开始状态及终止状态有关。将几个方程式进行叠加:①-②-③,整理可得C2H4(g) + H2O(g) = C2H5OH(g) , △H = (-23.9 + 29.1 - 50.7) KJ/mol = -45.5 KJ/mol;通过比较气相直接水合法和间接水合法使用的原料、产物可以发现:气相直接水合法具有污染小,腐蚀性小、无副产品,原子利用率100%等的优点;
(3)①乙烯水合制乙醇反应在图中A点的平衡常数
K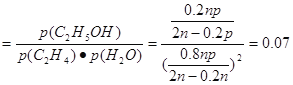 (MPa)-1;
(MPa)-1;
②由方程式C2H4(g) + H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4;
③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变n(H2O):n(C2H4)比等。
【考点地位】本题主要是考查方程式书写、反应热计算、平衡状态计算及外界条件对平衡状态的影响等
【名师点晴】本题以乙醇的制取方法为线索考查化学反应原理、方程式的书写、化学平衡移动原理、物质制取方案的比较、反应条件的选择、盖斯定律的应用、反应热、化学平衡常数的计算的知识。考查学生综合运用所学化学知识解决相关化学问题的能力。体现了化学是一门实用性学科,从而提高学生学习化学的积极性和学习的兴趣。在一定程度上考查了学生的知识的灵活运用能力和分析问题解决问题的能力。


科目:高中化学 来源: 题型:
【题目】下列有关燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作.不正确的是
A. 给试管、烧杯、蒸发皿和烧瓶加热时都要垫上石棉网
B. 酒精灯内盛酒精不得超过容积的![]()
C. 往试管里装粉末状药品.可以用纸槽
D. 酒精灯不慎碰翻着火,应立即用湿布盖灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,反应达到平衡的标志是
pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,反应达到平衡的标志是
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不在改变
④各组分质量分数不再改变 ⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q
⑥单位时间内m molA断键反应,同时p molC也断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是( )
A.都难溶于水,且密度比水小
B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生聚合反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组设计实验探究氮的化合物的性质,装置如图所示,其中A(装置未画出)为气体发生装置。检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解。
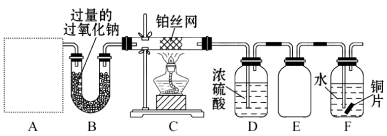
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填备选试剂的字母);
A.NH4HCO3 B.NH4Cl C.Ca(OH)2 D.NaOH
此时A中主要的玻璃仪器有 (填名称);
(2)对于C中发生的可逆反应,其方程式为: ;
有关该反应的下列说法中正确的是 。
A.增大一种反应物的浓度可以提高另一种反应物的转化率
B.工业上进行该反应时,可采取高压的条件提高反应物转化率
C.在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(3)E装置可防止F中溶液倒吸进入D中,请在上图中画出装置E中的导气管。
(4)写出F中发生反应的离子方程式: ;若进入F装置的物质成分和质量一定,可向F中加入下列物质(填字母)中的 使铜片溶解的质量增多。
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种过渡金属,外观呈现银白色,在现代工业中对于电池制造上有不可磨灭的地位。现代炼锌的方法可分为火法和湿法两大类.硫酸铅是生产锌的副产品。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1473-1573K,使锌蒸馏出来。将闪锌矿焙烧使它转化为氧化锌的主要化学反应方程式为。
(2)某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
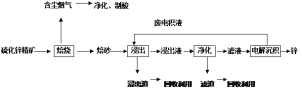
回答下列问题:
①焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
②浸出液“净化”过程中加入的主要物质为锌粉,其作用是。
③改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________
(3)工业冶炼锌的过程中,会产生铅浮渣(主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质),某科研小组研究利用铅浮渣生产硫酸铅的流程如下:
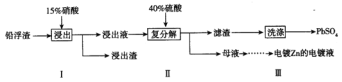
已知:25℃时,Ksp(CaSO4)=4.9×10-5,KSP(PbSO4)=1.6×10-8。
①已知步骤Ⅰ有NO气体产生,浸出液中含量最多的阳离子是Pb2+。写出Pb参加反应的化学方程式_____________________。
②步骤Ⅰ需控制Pb的用量并使Pb稍有剩余,目的是使Ag留在浸出渣中,产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去附着在硫酸铅表面的微溶物硫酸钙。沉淀转化反应的离子方程式是___。
③母液中可循环利用的溶质的化学式是_____________(填一种物质)
(4)现向含Pb2+、Ca2+浓度均为0.10mol/L的混合溶液中滴加0.10mol/LSO42-溶液.当Pb2+沉淀完全时,溶液中Ca2+浓度为mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海洋植物海带中提取碘的流程如下:

(1)灼烧海带时,盛放海带的仪器是 。
(2)用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞
C.检查分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收下层溶液
F.从分液漏斗上口倒出上层溶液
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗上的小孔
H.静置、分层
正确的操作顺序是 。
静置分层后,下层溶液的颜色为 。
(3)从碘的CCl4溶液中获得碘晶体还需要经过蒸馏,该实验需要的玻璃仪器除酒精灯、蒸馏烧瓶、温度计、锥形瓶、牛角管外,还需要 ,实验中温度计水银球所处位置为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢溶液长期存放会因分解而使溶液质量减轻,实验室有一瓶质量为100g的过氧化氢溶液,溶液中不再有气泡产生时,测得溶液质量共减少8g,则溶液中H2O2的物质的量为
A.8mol B.17mol C.0.5mol D.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com