

分析 (1)Cu+基态核外电子排布式1s22s22p63s23p63d10;
(2)A.阳离子核外电子数=质子总数-电荷数;
B.N5+ 离子中每个氮原子均满足8电子且呈对称结构,N5+离子的结构为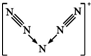 ,中间N原子有2对孤对电子;
,中间N原子有2对孤对电子;
C.根据B中分析判断;
D.N3-离子与二氧化碳分子核外等电子体;
(3)①A.由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形;
C.同周期随原子序数增大,第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能共有同周期相邻元素;
D.一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键,B-H键有3个,N-H键有3个,B-N有σ键有6个;
③氯化钠属于离子晶体,二氧化硅属于原子晶体;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,利用均摊法计算每个B原子连接O原子数目,进而确定多硼酸根离子符号;
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键;
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍;
根据图片知,每个氧化镍所占的面积=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°),每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)Cu+基态核外电子排布式1s22s22p63s23p63d10,基态 Cu+的最外层电子排布式为:3s23p63d10,
故答案为:3s23p63d10;
(2)A.1个氮原子中含有7个电子,则1个N5分子中含有35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有34个电子,故A错误;
B.N5+ 离子中每个氮原子均满足8电子且呈对称结构,N5+离子的结构为 ,中间N原子有2对孤对电子,有4对未成键的电子对,故B错误;
,中间N原子有2对孤对电子,有4对未成键的电子对,故B错误;
C.N5+离子的结构为 ,则N5+阳离子中存在两个氮氮三键,故C正确;
,则N5+阳离子中存在两个氮氮三键,故C正确;
D.N3-离子与二氧化碳分子核外等电子体,为直线型结构,故D正确;
故选:CD;
(3)①A.由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同周期随原子序数增大,第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能共有同周期相邻元素,故所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确,
故选:A;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键,B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个,
故答案为:12;
③氯化钠属于离子晶体,阴阳离子通过离子键相互作用,二氧化硅属于原子晶体,原子之间以共价键相互结合形成空间立体网状结构,故二者莫氏硬度相差较大,
故答案为:氯化钠属于离子晶体,阴阳离子通过离子键相互作用,二氧化硅属于原子晶体,原子之间以共价键相互结合形成空间立体网状结构;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,则每个B原子实际结合O原子数目为1+2×$\frac{1}{2}$=2,代一个单位负电荷,故多硼酸根化学式为:[BO2]nn-(或BO2-),
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键,故B原子采取sp2、sp3杂化,
故答案为:[BO2]nn-(或BO2-);sp2、sp3;
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍,所以其距离是 $\frac{\sqrt{2}}{2}$acm;
根据图片知,每个氧化镍所占的面积=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°)=4×1.40×10-10×1.40×10-10×sin60°m2,则每平方米含有的氧化镍个数=$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$,每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,所以每平方米含有的氧化镍质量=$\frac{74.7}{{N}_{A}}$g×$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$,=1.83×10-3,
故答案为:$\frac{\sqrt{2}}{2}$a;1.83×10-3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间结构、化学键、杂化轨道、晶体结构与计算等,(5)中注意计算“1NiO”的体积应包含孔隙体积,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>I2>S | B. | S>I2>Fe3+>Cl2 | C. | Fe3+>Cl2>H2S>I2 | D. | Cl2>I2>Fe3+>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘与干冰分别受热变为气体 | B. | 硝酸铵与硝酸分别受热变为气体 | ||
| C. | 氯化钠与氯化氢分别溶解在水中 | D. | 氧化铝与冰分别受热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4混中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com