
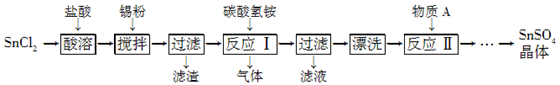
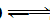 Sn(OH)Cl+HCl(不写可逆符号的也给分)
Sn(OH)Cl+HCl(不写可逆符号的也给分)

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
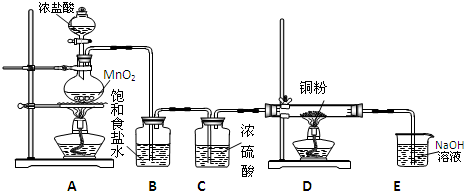
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
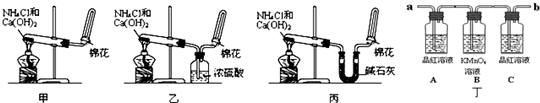
科目:高中化学 来源:不详 题型:实验题
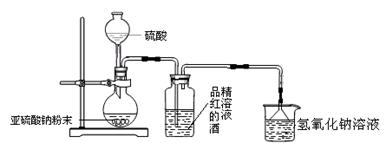

 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
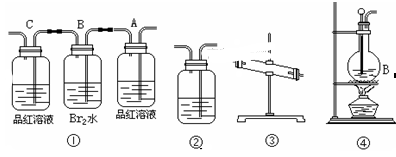
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
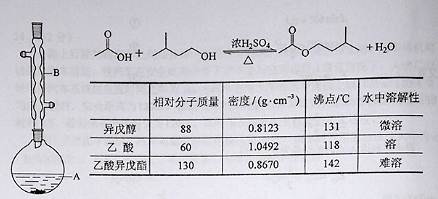
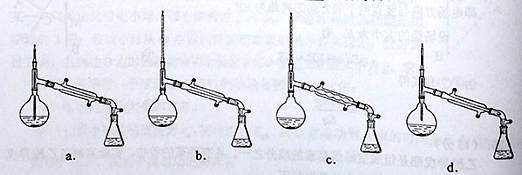
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

|
 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 | 反应体系 | 第一放热峰温度(℃) | 第二放热峰温度(℃) |
| l | KC1O3 | 400(无气体放出) | 480(有少量气体放出) |
| 2 | KC1O3+MnO2 | 350(有大量气体放出) | |
 KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。| 实验步骤 | 实验现象 | 实验结论 |
| 将产生的气体接触湿润的淀粉碘化钾试纸 | | 假设l正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| | | 假设2正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com