
| 容器 | SO2(mol) | O2(mol) | N(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | 在上述条件下反应生成1molSO3气体放热98.5 kJ | |
| B. | Q1=2Q2=2Q3=197 kJ | |
| C. | 上述条件下1mol O2参加反应放出的热量为197 kJ/mol | |
| D. | Q2<Q3<Q1<197kJ |
分析 由热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol的意义可判断A、C选项的正误;反应为可逆反应,浓度不同,平衡转化的程度不等,氮气对平衡移动没有影响,以此判断B、D项.
解答 解:反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,
A、由热化学方程式可知,在上述条件下反应生成1molSO3气体放热98.5kJ,故A正确;
B、由C分析可知2Q2=2Q3<Q1,又反应为可逆反应,则Q1<197kJ,故B错误;
C、由热化学方程式的意义可知,在上述条件下每摩该反应进行到底时放出的热量为197kJ,1mol O2参加反应放出的热量小于197 kJ/mol,故C错误;
D、由于反应物的物质的量不同,则反应物的浓度不同,平衡转化的程度则不同,浓度越大,越有利于平衡向正方向移动,所以2Q2<Q1,在该反应中,氮气对平衡移动没有影响,则Q2=Q3,故D错误;
故选A.
点评 本题考查反应热的计算,题目难度中等,本题注意浓度对平衡的影响以及可逆反应的特征.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c({CH}_{3}C{OO}^{-})}{c({CH}_{3}COOH)}$的值增大到原来的100倍 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-═AlO2-+NH3•H2O+2BaSO4↓ | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
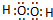 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验时,如果没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 | |
| B. | 用pH试纸测定溶液的pH值时,先把试纸放在待测液中,然后比色 | |
| C. | 含NO2球放在热水中的平衡球颜色加深,放入冷水中的平衡球颜色变浅 | |
| D. | 向盛有FeCl3溶液的试管中加入KSCN溶液,立即生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
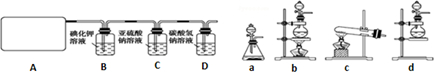
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

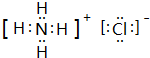 ,I的化学式Mg(OH)2;
,I的化学式Mg(OH)2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
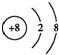 ;A、F两元素组成的化合物电子式为Na+[:H]-.
;A、F两元素组成的化合物电子式为Na+[:H]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO与NaOH溶液反应 H++OH-═H2O | |
| B. | CaCO3与稀盐酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | Fe和稀H2SO4反应 2Fe+6H+═2Fe3++3H2↑ | |
| D. | 盐酸和Ba(OH)2溶液反应 H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com