
【题目】利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择合适的完成指定转化。
试剂:S、CO2、Na2CO3溶液、Na3PO4溶液、K2SO4溶液、浓硝酸、浓盐酸
①K2O(一种碱性氧化物)K2CO3的化学方程式:___;
②PH3PO4的化学方程式:___;
③浓硫酸SO2的化学方程式:___。
(2)根据如图所示物质的转化信息书写相应的反应方程式。

①“反应Ⅱ”为复分解反应,写出该反应的化学方程式:___;
②“反应Ⅰ”的产物之一为NaCl,写出该反应的化学方程式:___。
【答案】K2O+CO2=K2CO3 P+5HNO3(浓)=H3PO4+5NO2↑+H2O S+2H2SO4(浓)=3SO2↑+2H2O 2KCl+Na2FeO4=K2FeO4↓+2NaCl Fe2O3+3NaClO+4NaOH=2Na2FeO4+3NaCl+2H2O
【解析】
①K2O和酸性氧化物反应生成盐;
②P发生氧化反应生成H3PO4,需要加入氧化剂;
③浓硫酸发生还原反应生成SO2,需要加入还原剂;
(2)根据流程图,Fe2O3、NaClO、NaOH氧化还原反应生成氯化钠、Na2FeO4;Na2FeO4与KCl发生复分解反应生成K2FeO4沉淀。
①K2O和酸性氧化物二氧化碳反应生成K2CO3,反应的化学方程式是K2O+CO2=K2CO3;
②P发生氧化反应生成H3PO4,需要加入氧化剂浓硝酸;化学方程式是P+5HNO3(浓)=H3PO4+5NO2↑+H2O;
③浓硫酸发生还原反应生成SO2,需要加入还原剂S;化学方程式是S+2H2SO4(浓)=3SO2↑+2H2O;
(2)①“反应Ⅱ”Na2FeO4与KCl发生复分解反应生成K2FeO4沉淀,反应方程式是2KCl+Na2FeO4=K2FeO4↓+2NaCl;
②“反应Ⅰ”是Fe2O3、NaClO、发生氧化还原反应生成氯化钠、Na2FeO4,反应的化学方程式是Fe2O3+3NaClO+4NaOH=2Na2FeO4+3NaCl+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列说法正确的是
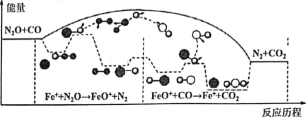
A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移lmol电子,则消耗1molN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。
(1)钠的原子结构示意图为___。
(2)写出该反应的化学方程式___;其中钠熔成闪亮小球的原因是___。
(3)将所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:___。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式___;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为___(填化学式),如称量其质量为4.0g,通过计算,可知最初加入的金属钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是
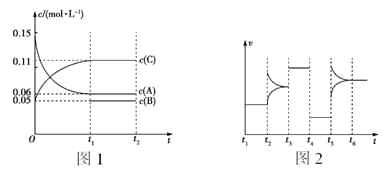
A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计蔗糖与浓硫酸反应的实验装置如下,并进行系列实验(必要时可对甲适当加热)。下列说法中正确的是
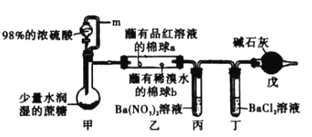
A.可观察到棉球a、b都褪色,且褪色的原理相同
B.丙、丁中都能观察到有白色沉淀生成
C.实验过程中观察到的系列现象,可验证浓硫酸具有吸水性、脱水性和氧化性
D.m管的作用是平衡压强,戊的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
A.检验溶液是否含有SO![]() 时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe3+时,用硝酸酸化
D.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是
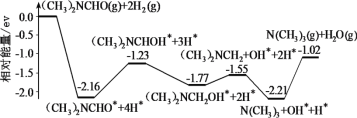
A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH*
B.该历程中最大能垒(活化能)为2.16eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02evmol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用NH3催化还原NOx时包含以下反应.
反应①:4NH3 (g)+6NO(g) ![]() 5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
反应②:4NH3(g)+6NO2(g) ![]() 5N2(g)+3O2(g)+6H2O(l) H2=?
5N2(g)+3O2(g)+6H2O(l) H2=?
反应③:2NO(g)+O2(g) ![]() 2NO2(g) H3=-113.0kJ·mol一1
2NO2(g) H3=-113.0kJ·mol一1
(1)反应②的H2==_____________。
(2)为探究温度及不同催化剂对反应①的影响.分别在不同温度、不同催化剂下.保持其他初始条件不变重复实验.在相同时间内测得N2浓度的变化情况如下图所示。

①反应①的平衡常数的表达式K=________。相同温度下.在催化剂甲的作用下反应的平衡常数______(填“大于”“小于”或“等于”)在催化剂乙的作用下反应的平衡常数。
②N点后N2浓度减小的原因可能是_____________________。
(3)某温度下,在1 L恒容密闭容器中初始投入4 mol NH3和6 mol NO发生反应①.当气体总物质的量为7.5mol时反应达到平衡.则NH3的转化率为____,达平衡所用时间为5 min.则用NO表示此反应0~5 min内的平均反应速率为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com