

| A. | 该分子中所有氢原子不可能在同一平面上 | |
| B. | 1mol该物质与氢气反应,最多消耗4mol氢气 | |
| C. | 加入FeCl3溶液呈紫色,因为该物质含有酚类结构特征 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,可证明结构存在碳碳双键 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:多选题
| A. | H2O的摩尔质量是18g | |
| B. | 一个12C的实际质量约等于$\frac{12}{6.02×1{0}^{23}}$g | |
| C. | 任何物质的摩尔质量都等于它的式量 | |
| D. | SO2的摩尔质量是64g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
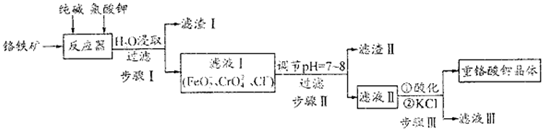
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 2 mol•L-1盐酸 | B. | 150 mL 2 mol•L-1硫酸 | ||
| C. | 500 mL 3 mol•L-1盐酸 | D. | 500 mL 18.4 mol•L-1浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 B
B E
E
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
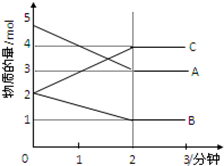 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | Na+、NH4+、HCO3-、SO42- | ||
| C. | NH4+、Ca2+、I-、SO42- | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原醋酸物质的量浓度等于0.01mol•L-1 | |
| B. | 反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol•L-1 | |
| C. | 两种反应物中水电离出的c(H+)都是1×10-12mol•L-1 | |
| D. | 反应后的溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com