
���� ��1������ƿֻ��һ���̶��ߣ���ֻ�����ƺ��������Ӧ���������Һ���ݴ�ѡ���ȼ����Ũ��������ʵ���Ũ��Ϊc=��Ȼ�������Һϡ�Ͷ���CŨVŨ=CϡVϡ�����㣻
��2���������Ʋ����Ǽ��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ����������˳��
��3������c=$\frac{n}{V}$��������ʵ����ʵ���n����Һ�����V�ı仯��������������
��� �⣺��1������ƿֻ��һ���̶��ߣ���ֻ�����ƺ��������Ӧ���������Һ��������250mL��ҺӦѡ��250mL����ƿ��Ũ��������ʵ���Ũ��Ϊc=$\frac{1000�Ѧ�}{M}$=$\frac{1000��1.25��36.5%}{36.5}$=12.5mol/L������Ҫ��Ũ��������ΪVmL��������Һϡ�Ͷ���CŨVŨ=CϡVϡ��֪��12.5mol/L��VmL=0.1mol/L��250mL
���V=2.0mL���ʴ�Ϊ����250��2.0��
��2���������Ʋ����Ǽ��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��֪����˳��ΪBCAFED���ʴ�Ϊ��BCAFED��
��3��A������ʱNaOH�����Ѿ����⣬���������Ƶ���ʵ����ƫС�������Ƴ���Ũ��ƫ�ͣ���A��ȷ��
B��������ƿ��ת����Һʱ������ƿ������������ˮ����������Һ��Ũ����Ӱ�죬��B����
C��ҡ�Ⱥ���Һ����ڿ̶����������ģ��μ�����ˮ���̶�����ҡ�ȣ�����Һ��Ũ�Ȼ�ƫ�ͣ���C��ȷ��
D������ʱ��������ƿ�Ŀ̶��ߣ�����Һ���ƫС��Ũ��ƫ�ߣ���D����
E��������ƿ��ת����Һʱ������Һ����������ƿ���棬�ᵼ�����ʵ���ʧ����Ũ��ƫ�ͣ���E��ȷ��
F��������ˮʱ���������̶��ߣ�����Һ���ƫ��Ũ��ƫС����F��ȷ��
��ѡACEF��
���� ���⿼����һ�����ʵ���Ũ����Һ�����ƹ����еļ���������������ڻ�������Ŀ���ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -74.8kJ��mol-1 | B�� | +74.8kJ��mol-1 | C�� | -149.6kJ��mol-1 | D�� | +149.6kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�ͭ��Һ�����۷�Ӧ��Cu2++Fe�TFe2++Cu | |
| B�� | ̼��������ᷴӦ��CaCO3+2H+�TH2O+CO2�� | |
| C�� | ����������Һ��ϡ���ᷴӦ��Ba2++SO${\;}_{4}^{2-}$�TBaSO4�� | |
| D�� | ϡ���������۷�Ӧ��2Fe+6H+�T2Fe3++3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ƶ���ˮ�ڹ�����������ɫ��dz | |
| B�� | ����������Լӿ�ϳɰ������� | |
| C�� | ʵ�����г����ű���ʳ��ˮ�ķ����ռ����� | |
| D�� | ��ҵ����������Ĺ�����ʹ�ù����Ŀ�������߶�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
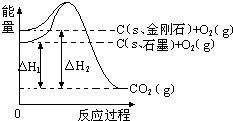
| A�� | C��s��ʯī���TC��s�����ʯ����H=+1.9kJ•mol-1 | |
| B�� | ʯī�ͽ��ʯ��ת���������仯 | |
| C�� | ʯī���ȶ���ǿ�ڽ��ʯ | |
| D�� | 1molʯī���ܼ��ܱ�1mol���ʯ���ܼ���С1.9kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ϊ��������ܸ�ʴ���ڴ��������װ������п�飬��Ϊ�������������������� | |
| B�� | ԭ��ع���ʱ�������ķ��������������ء�������ԭ����е������Һ������ | |
| C�� | ��������п�����Ʋ��������Ƥ��Ȼ�ܵ����� | |
| D�� | ������Ʒ�϶�ͭʱ������Ʒ����Ƴص�������ͭ��Ϊ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  �ȽϷǽ�����ǿ����S��C��Si �ȽϷǽ�����ǿ����S��C��Si | B�� |  ����CH3COOC2H5�ͱ���̼������Һ ����CH3COOC2H5�ͱ���̼������Һ | ||
| C�� |  �۲촿�����ɫ��Ӧ �۲촿�����ɫ��Ӧ | D�� |  ���� �Ƚ�Na2CO3��NaHCO3�����ȶ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2 | B�� | CO2 | C�� | SO2 | D�� | NO |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com