
【题目】下列说法正确的是( )
A.实验室将少量Na保存在乙醇中
B.可用激光笔鉴别FeCl3溶液和Fe(OH)3胶体
C.32 g O3中含有的氧原子数约是3×6.02×1023
D.常温下,可以用铝制容器来储运浓盐酸
【答案】B
【解析】
A. 金属钠的密度大于煤油,且能和乙醇反应;
B. 区分溶液和胶体常用的方法是丁达尔效应;
C. 32 g O3的物质的量为![]() =
=![]() mol,计算出氧原子的物质的量后根据N= nNA计算出氧原子的个数;
mol,计算出氧原子的物质的量后根据N= nNA计算出氧原子的个数;
D. 金属铝可以和浓盐酸反应。
A. 金属钠能和乙醇反应,且密度大于煤油,因此实验室将少量Na保存在煤油中,A项错误;
B. 区分溶液和胶体常用的方法是丁达尔效应,因此可用激光笔鉴别FeCl3溶液和Fe(OH)3胶体,B项正确;
C. 32 g O3的物质的量为![]() =
=![]() mol,含有的氧原子的物质的量为
mol,含有的氧原子的物质的量为![]() mol×3=2mol,因此氧原子数约是2×6.02×1023,C项错误;
mol×3=2mol,因此氧原子数约是2×6.02×1023,C项错误;
D. 金属铝可以和浓盐酸持续地反应,不能用铝制容器来储运浓盐酸,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 与
与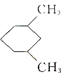 的一氯代物数目相同(不考虑立体异构)
的一氯代物数目相同(不考虑立体异构)
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.淀粉溶液中加入稀硫酸,加热4-5min,再加入少量银氨溶液,加热,有光亮银镜生成
D.福尔马林能使蛋白质发生变性,可用于浸制动物标本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
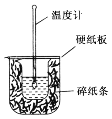
(1)从实验装置上看,图中尚缺少一种玻璃仪器是___。
(2)实验中改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热___(填“相等”、“偏小”或“偏大”)。
(3)若测得该反应的中和热为57.3kJ/mol,请写出表示中和热的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A为无色黏稠液体。为研究A的组成与结构,进行了如下实验:
(1)称取A升温使其汽化,测其密度是相同条件下H2的69倍。实验结论:A的相对分子质量为___。
(2)将13.8gA在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和30.8g。则A的分子式为___。
(3)A既能发生银镜反应,又能水解,若将13.8gA与足量金属钠反应则生成1.12LH2(标准状况)。则A中含有的官能团(名称):____。
(4)A的核磁共振氢谱峰的面积之比为1:2:2:1。实验结论:A的结构简式为____。
(5)与A互为同分异构体的芳香族化合物,还有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼![]() 是一种重要的过渡金属元素,工业上由钼精矿
是一种重要的过渡金属元素,工业上由钼精矿![]() 主要成分是
主要成分是![]() 制备单质钼和钼酸钠晶体
制备单质钼和钼酸钠晶体![]() 的流程如下:
的流程如下:

![]() 中Mo元素的化合价为______;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为______。
中Mo元素的化合价为______;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为______。
![]() 流程中由
流程中由![]() 溶液获得晶体的操作是______、过滤、洗涤、干燥。加入
溶液获得晶体的操作是______、过滤、洗涤、干燥。加入![]() 溶浸时发生的主要反应的离子方程式为______。
溶浸时发生的主要反应的离子方程式为______。
![]() 操作1中,所得
操作1中,所得![]() 溶液中含
溶液中含![]() 杂质,其中
杂质,其中![]() ,
,![]() ,在结晶前需加入
,在结晶前需加入![]() 固体以除去溶液中的。当
固体以除去溶液中的。当![]() 开始沉淀时,
开始沉淀时,![]() 的去除率是______。
的去除率是______。![]() 、
、![]()
![]() ,溶液体积变化可忽略
,溶液体积变化可忽略![]()
![]() 工业上钼精矿在酸性条件下,加入
工业上钼精矿在酸性条件下,加入![]() 溶液,也可以制备钼酸钠,该法的优点是______。
溶液,也可以制备钼酸钠,该法的优点是______。
![]() 高纯Mo可用于制造电池级
高纯Mo可用于制造电池级![]() ,
,![]() 电池是一种性能优异的二次电池,其电池反应为:
电池是一种性能优异的二次电池,其电池反应为:![]()
![]()
![]() 该电池放电时正极反应为______;充电时
该电池放电时正极反应为______;充电时![]() 移动方向为______
移动方向为______![]() 填“由阳极移向阴极”或“由阴极移向阳极”
填“由阳极移向阴极”或“由阴极移向阳极”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列五种物质:
A. O2和O3
B.![]() 和
和![]()
C.CH3COOCH2CH3和CH3COOCH3
D.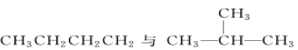
E. 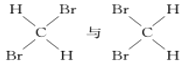
①________组两种物质互为同位素; ②________组两种物质互为同素异形体;
③________组两种物质互为同系物; ④________组两种物质互为同分异构体;
⑤________组两种物质为同一种物质;
(2)现有六种有机物:
A. CH3OH B.(CH3)3CCH2OH C.(CH3)3COH
D. (CH3)2CHOH E. C6H5CH2OH F. (CH3)2CHCl
①能被氧化铜氧化生成醛的有________。
②能被氧化铜氧化成酮的有________。
③能发生消去反应生成烯烃的有________。
(3)现有四种有机物:
A. (CH3)2CHCl B. CH3COOCH C. OHCCH2COOH D. CH3COOCH3
①能与新制Cu(OH)2反应的有________。
②能与NaOH水溶液反应的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N是短周期元素,它们的核电荷数依次增大。
元素 | 元素性质或原子结构 |
W | 单质在氯气中燃烧,产生苍白色火焰 |
X | 在Y的上一周期,原子核外s能级上的电子总数与p能级上的电子总数相等 |
Y | 元素的离子半径在该周期中最小 |
Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
N | 最外层电子数比次外层电子数少1 |
(1)W单质的化学式为_______,Z元素原子核外有_________个原子轨道填充了电子。
(2)Y、Z和N三种元素第一电离能由大到小的顺序为____________(填元素符号),写出Y3+在过量氨水中反应的离子方程式 ____________。
(3)用电子式表示X与W构成的化合物的形成过程________。
(4)Z元素原子共有________种不同运动状态的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物溶于水,所得溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,且各种离子的物质的量相同。为了确定其组成,进行如下实验:
中的几种离子,且各种离子的物质的量相同。为了确定其组成,进行如下实验:
(1)取一定量的样品,加足量水充分溶解,得到澄清溶液。
(2)取少量溶液,滴入足量稀硝酸,再滴入足量硝酸钡溶液,有沉淀生成;充分振荡,静置,向上层清液中滴入硝酸银溶液,有沉淀生成。
(3)再取少量![]() 中溶液,加入氢氧化钠溶液,有沉淀生成。
中溶液,加入氢氧化钠溶液,有沉淀生成。
根据上述实验现象,该固体样品的成分可能是
A.该混合物一定是NaCl和![]()
B.该混合物一定是NaCl和![]()
C.该混合物可能是![]() 和
和![]()
D.该混合物可能是![]() 和
和![]() 3
3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用如图所示的装置制取乙酸乙酯。
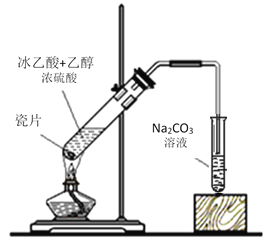
(1)浓硫酸的作用是:① _______________;② ______________。
(2)右边装置中通蒸气的导管要插在液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是____________。
(3)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(4)若加的是C2H518OH写出制乙酸乙酯的方程式___________。
II.某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出乙醇催化氧化的化学方程式____________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_______反应。
(2)甲和乙两个水浴作用不相同。甲的作用是_________;乙的作用是___________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是__________。集气瓶中收集到的气体的主要成分是____________。
(4)图中丙处导管应倾斜的原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com