
【题目】能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是
A、甲烷 B、氯化铁 C、乙烷 D、乙烯
科目:高中化学 来源: 题型:
【题目】一氯胺(NH2Cl,Cl呈+1价)可用于制备液体火箭燃料偏二甲肼。实验室制备一氯胺可用氨气与次氯酸或次氯酸盐反应,某实验小组设计如下装置制备NH2Cl。
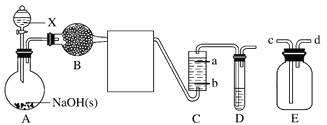
(1)试剂X是________(填名称,下同),B中盛装的试剂是________。
(2)E置于B、C之间,可用于收集制备的气体,收集时,气体从________(填“c”或“d”)口进入。
(3)若C中盛装的是饱和食盐水,则惰性电极b应与电源________极相连。
(4)电解一段时间后,通入氨气,写出氨气与次氯酸钠反应生成NH2Cl的化学方程式:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不属于氧化还原反应的是( )
A.2Na+2H2O=2NaOH+H2↑B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2↑D.SO3+H2O=H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签,
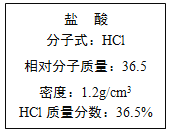
试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L的稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 。
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是 (填字母)。
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 mol/L。(填选项字母)
a.![]() b.
b.![]()
c.![]() d.
d.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中除含有Ca2+、Mg2+、SO![]() 等可溶性杂质外,还含有泥砂等不溶性杂质。
等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO![]() 的方法是______________________________________。
的方法是______________________________________。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。滴加Na2CO3溶液时发生反应的离子方程式为__________________。
(3)用四氯化碳提取出溴水中的溴的方法叫做___________,将溴的四氯化碳溶液和水分离开的操作叫做___________,下列是进行该操作的步骤,正确的顺序是_______________。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接收溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如图所示:
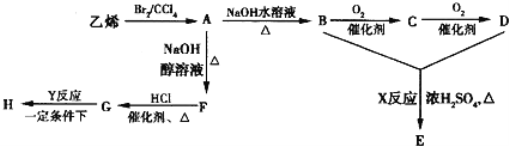
请回答下列问题:
(1)写出A的结构简式:______________,C的名称是___________。
(2)一定条件下三分子F发生聚合,所的产物的结构简式为__________。
(3)写出以下反应的化学方程式:
A→B:___________________________;
G→H:___________________________。
(4)将环状酯E与NaOH水溶液共热,则发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2O2与CO2的反应中,下列说法正确的是
A. 该反应中Na2O2是氧化剂,CO2是还原剂
B. 1mol Na2O2参加反应,有2mole—转移
C. Na2O2晶体中阴阳离子个数比为1:2
D. CO2分子中含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E可作酸味剂。有关转化关系如下
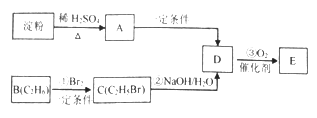
已知:![]()
请回答下列问题:
(1)有机物D中含有的官能团名称是________________。
(2)反应①③中属于取代反应的是_____________。
(3)写出A→D反应的化学方程式_______________________。
(4)下列说法正确的是________。
A.可以用碘化钾溶液检验淀粉是否完全转化为A
B.B能使Br2的CCl4溶液褪色
C.化合物C不存在同分异构体
D.D和E在浓硫酸条件下能反应生成密度比水小的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:

(1)Ti元素原子序数为22,它在元素周期表中的位置是第 周期第 族;其基态原子的电子排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图1所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 。
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点﹣23.2℃,沸点136.2℃,所以TiCl4应是
化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请将其结构画出_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com