
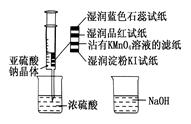
| A.蓝色石蕊试纸先变红后褪色 |
| B.品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性 |
| C.湿润淀粉KI试纸变蓝说明SO2的氧化性弱于I2 |
| D.NaOH溶液可用于除去实验中多余的SO2 |
科目:高中化学 来源:不详 题型:实验题
 __________________ _ __________
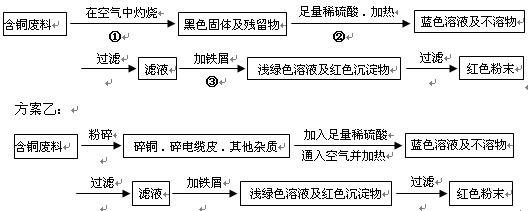
__________________ _ __________| 序号 | 实验操作 | 实验现象 | 结论及离子方程式 |
| ① | 取适量的样品于试管内 | —— | —— |
| ② | 用滴管滴入足量硫酸溶液,并充分振荡试管 | | |
| ③ | | 溶液先黄色,滴入KSCN溶液后显红色 | |
| | | | |
 师的建议完成上面操作步骤,获得晶体后对其进行检测
师的建议完成上面操作步骤,获得晶体后对其进行检测查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
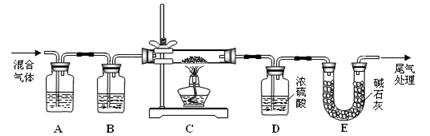
 到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | C/mol·l-1:] | |
| KMnO4 | H2C2O4 | ||||
| ① | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| ③ | | 323 | 0.5 | 0.01 | 0.1 |
| ④ | 探究催化剂对反应速率的影响 | | | | 0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
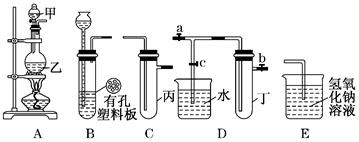
| 实验 序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气 泡产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
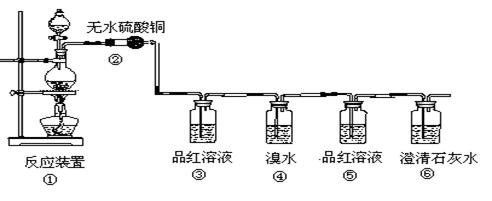
 漏气。
漏气。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
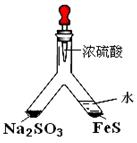
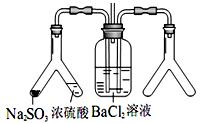
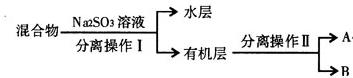
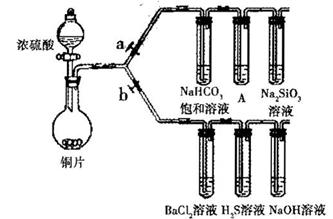
 验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。
验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。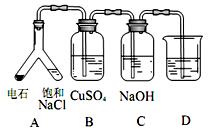
 证电石气的主要成分,D中盛放______________。
证电石气的主要成分,D中盛放______________。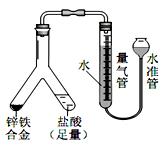
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 和C
和C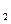 H
H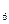 的比例关系,设计实验如下图所示:
的比例关系,设计实验如下图所示: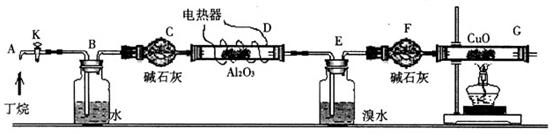
 D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…… 和H
和H O;A
O;A l
l O
O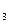 是烷烃裂解的催化剂;G后面装置已省略。
是烷烃裂解的催化剂;G后面装置已省略。 和C
和C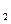 H
H

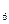 的物质的量之比n(CH
的物质的量之比n(CH ):n(C
):n(C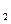 H
H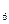 )=______________。
)=______________。

 SO
SO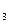 溶液的作用是______________________。
溶液的作用是______________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.实验室制取乙烯气体时,将温度计的水银球放入液面以下 |
| B.可用酒精洗涤沾有苯酚的试管 |
| C.证明分子CH2=CH-CHO既含有醛基又含有C=C,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 |
D.配制银氨溶 液时,将硝酸银 液时,将硝酸银 溶液逐滴滴入氨水中 溶液逐滴滴入氨水中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
 还原性并生成沉淀的离子方程式_________
还原性并生成沉淀的离子方程式_________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com