
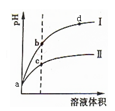
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究 不同温度 不同温度 对镁与盐酸反应速率的影响;b.实验①和③是探究 不同浓度 不同浓度 对镁与盐酸反应速率的影响;c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 298 298 |
0.20 0.20 |
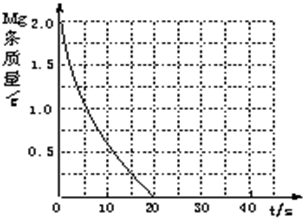
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
| | | |
| | | |
| | | |
| | | |
回答下列各问:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?__________________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,对于H3PO4此规律是________________,产生此规律的原因是_________________________.
![]() (5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
(5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
①用pH试纸测量溶液的pH值,即可求得C平衡(OH-),测定溶液pH值的操作是______________。
②测量C平衡(NH3∙H2O)的方法最好用_____________法(填方法名称)
③求此温度下该反应的平衡常数K.(写出计算过程,计算结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源:2010年广东省执信中学高二上学期期中考试化学卷 题型:填空题
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
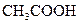 | 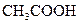  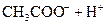 |  |
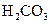 |  | 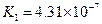 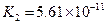 |
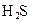 | 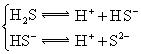 | 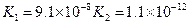 |
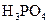 | 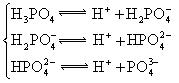 | 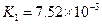 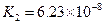 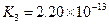 |
查看答案和解析>>
科目:高中化学 来源:09-10年台州市高二下学期期末考试化学卷 题型:计算题
某温度下,纯水中c(H+)=1.0×10-6 mol·L-1,则此时c(OH-)= ▲ mol·L-1。
在此温度下,将100 mL pH=1的稀硫酸和盐酸的混合液与100 mL未知浓度的Ba (OH)2溶液相混合,充分反应后过滤,得0.233g沉淀,滤液的pH值变为11(设混合液体积为两者之和,所得固体体积忽略不计)。
则原混合酸液中SO42-的物质的量= ▲ mol。
Cl-的物质的量= ▲ mol。
Ba(OH)2的物质的量浓度= ▲ mol·L-1 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com