
| A£® | ÓÉX”¢Z”¢MČżÖÖŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļŅ»¶ØŹĒ¹²¼Ū»ÆŗĻĪļ | |
| B£® | QÓėMŠĪ³ÉµÄ»ÆŗĻĪļæÉŅŌ×÷ĪŖ¹āµ¼ĻĖĪ¬µÄÖ÷ŅŖŌĮĻ£¬ĒŅ²»ÓėČĪŗĪĖį·“Ó¦ | |
| C£® | ŌŖĖŲµÄ·Ē½šŹōŠŌÓÉĒæµ½ČõµÄĖ³Šņ£ŗM£¾Z£¾Q£¾Y | |
| D£® | Ō×Ó°ė¾¶Óɓ󵽊”µÄĖ³Šņ£ŗN£¾Q£¾Z£¾M |
·ÖĪö ĮłÖÖŌŖĖŲX”¢Y”¢Z”¢M”¢N”¢QµÄŌ×ÓŠņŹżŅĄ“ĪŌö“óĒŅ²»“óÓŚ18£¬µ„ÖŹQŹĒŅ»ÖÖÖŲŅŖµÄ°ėµ¼Ģå²ÄĮĻ£¬ŌņQĪŖSiŌŖĖŲ£¬YÓėQĶ¬Ö÷×壬ĖłŅŌYĪŖCŌŖĖŲ£»XÓėNĶ¬Ö÷×壬ŅŃÖŖ³£ĪĀĻĀµ„ÖŹXÓėNµÄדĢ¬²»Ķ¬£¬½įŗĻŌ×ÓŠņŹżæÉÖŖ£¬XÓ¦ĪŖHŌŖĖŲ£¬NĪŖNaŌŖĖŲ£»MµÄŗĖµēŗÉŹżŹĒYµÄ×īĶā²ćµē×ÓŹżµÄ2±¶£¬ŌņMµÄŗĖµēŗÉŹżĪŖ2”Į4=8£¬ĪŖOŌŖĖŲ£¬ŌņZÓ¦ĪŖNŌŖĖŲ£¬½įŗĻŌŖĖŲÖÜĘŚĀɵĵŻ±ä¹ęĀɽā“šøĆĢā£®
½ā“š ½ā£ŗĮłÖÖŌŖĖŲX”¢Y”¢Z”¢M”¢N”¢QµÄŌ×ÓŠņŹżŅĄ“ĪŌö“óĒŅ²»“óÓŚ18£¬µ„ÖŹQŹĒŅ»ÖÖÖŲŅŖµÄ°ėµ¼Ģå²ÄĮĻ£¬ŌņQĪŖSiŌŖĖŲ£¬YÓėQĶ¬Ö÷×壬ĖłŅŌYĪŖCŌŖĖŲ£»XÓėNĶ¬Ö÷×壬ŅŃÖŖ³£ĪĀĻĀµ„ÖŹXÓėNµÄדĢ¬²»Ķ¬£¬½įŗĻŌ×ÓŠņŹżæÉÖŖ£¬XÓ¦ĪŖHŌŖĖŲ£¬NĪŖNaŌŖĖŲ£»MµÄŗĖµēŗÉŹżŹĒYµÄ×īĶā²ćµē×ÓŹżµÄ2±¶£¬ŌņMµÄŗĖµēŗÉŹżĪŖ2”Į4=8£¬ĪŖOŌŖĖŲ£¬ŌņZÓ¦ĪŖNŌŖĖŲ£»
A£®XĪŖH£¬ZĪŖN£¬MĪŖO£¬ČżÖÖŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļæÉĪŖNH4NO3£¬ĪŖĄė×Ó»ÆŗĻĪļ£¬¹ŹA“ķĪó£»
B£®QÓėMŠĪ³ÉµÄ»ÆŗĻĪļ¶žŃõ»Æ¹čæÉŅŌ×÷ĪŖ¹āµ¼ĻĖĪ¬µÄÖ÷ŅŖŌĮĻ£¬¶žŃõ»Æ¹čÓėĒā·śĖį·“Ó¦£¬¹ŹB“ķĪó£»
C£®ŌŖĖŲµÄ·Ē½šŹōŠŌÓÉĒæµ½ČõµÄĖ³ŠņŹĒO£¾N£¾C£¾Si£¬¼“M£¾Z£¾Y£¾Q£¬¹ŹC“ķĪó£»
D£®Ō×Ó°ė¾¶Na£¾Si£¬N£¾O£¬NŗĶOŌŚµŚ¶žÖÜĘŚ£¬NaŗĶSiŌŚµŚČżÖÜĘŚ£¬ŌņŌ×Ó°ė¾¶Na£¾Si£¾N£¾O£¬¼“N£¾Q£¾Z£¾M£¬¹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éŌ×Ó½į¹¹ÓėŌŖĖŲÖÜĘŚĀɵĹŲĻµ£¬ĢāÄæÄѶČÖŠµČ£¬±¾Ģā×¢Ņāøł¾ŻĪļÖŹµÄĶØĶ¾ŅŌ¼°¶ŌÓ¦ŌŖĖŲµÄŌ×Ó½į¹¹ĶʶĻŌŖĖŲµÄÖÖĄą£¬Ń§Ļ°ÖŠ×¢Ņā°ŃĪÕŌŖĖŲÖÜĘŚĀɵĵŻ±ä¹ęĀÉ£®


 æ¼Ē°±ŲĮ·ĻµĮŠ“š°ø
æ¼Ē°±ŲĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3 | B£® | 4 | C£® | 5 | D£® | 6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
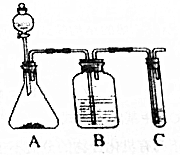 ĄūÓĆČēĶ¼×°ÖĆ»¹æÉŅŌŃéÖ¤“×Ėį”¢±½·Ó”¢Ģ¼ĖįµÄĖįŠŌĒæČõ£®
ĄūÓĆČēĶ¼×°ÖĆ»¹æÉŅŌŃéÖ¤“×Ėį”¢±½·Ó”¢Ģ¼ĖįµÄĖįŠŌĒæČõ£®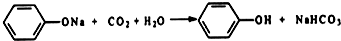 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆČÜŅŗµÄÖŠĖ®µēĄė³öµÄc£ØH+£©=10-amol/L | |
| B£® | ¼ÓĖ®Ļ”ŹĶ£¬“×ĖįÄʵÄĖ®½ā³Ģ¶ČŌö“ó£¬Ė®µÄµēĄė³Ģ¶ČŅ²Ōö“ó | |
| C£® | ¼ÓČėŃĪĖį£¬pH=7Ź±£¬ÓŠc£ØCl-£©=c£ØCH3COOH£© | |
| D£® | ĻņČÜŅŗÖŠ¼ÓČė“×Ėį³ŹĖįŠŌ£¬ŌņŅ»¶ØŹĒc£ØCH3COO-£©£¾c£ØNa+£©£¾c£ØH+£©£¾c£ØOH-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C2H6O | B£® | CH3O | C£® | C4H12O2 | D£® | C5H10O4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņijČÜŅŗÖŠ¼ÓČė×ćĮæĻ”ĮņĖį£¬ĪŽĆ÷ĻŌĻÖĻó£¬ŌŁ¼ÓČėAgNO3ČÜŅŗ£¬³öĻÖ°×É«³Įµķ£¬ŌņČÜŅŗÖŠÓŠCl- | |
| B£® | ĻņijČÜŅŗÖŠµĪ¼ÓÅØĮņĖį£¬½«²śÉśµÄĘųĢåĶØČėĘ·ŗģČÜŅŗÖŠ£¬Ę·ŗģĶŹÉ«£¬ŌņČÜŅŗÖŠŅ»¶ØÓŠSO32- | |
| C£® | ÓĆ½ą¾»µÄ²¬ĖæÕŗČ”Ä³ČÜŅŗŌŚĪŽÉ«»šŃęÉĻ×ĘÉÕ£¬Ķø¹żĄ¶É«īܲ£Į§¹Ū²ģ»šŃę³Ź×ĻÉ«£¬ŌņČÜŅŗÖŠÓŠK+ | |
| D£® | ŌŚÄ³ČÜŅŗÖŠ£¬ĻČ¼ÓČė×ćĮæBaCl2ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£»ŌŁ¼ÓČė×ćĮæĻ”ŃĪĖį£¬³Įµķ²»Čܽā£¬ŌņÖ¤Ć÷øĆČÜŅŗÖŠŗ¬SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č/”ę | 800 | 1000 | 1200 | 1400 |
| Ę½ŗā³£Źż | 0.45 | 1.92 | 276.5 | 1771.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 4 | B£® | 5 | C£® | 6 | D£® | 7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ü¢Ū¢Ł¢Ż | B£® | ¢Ś¢Ū¢Ż¢Ł | C£® | ¢Ž¢Ū¢Ü¢Ł | D£® | ¢Ž¢Ū¢Ł¢Ż |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com