
A.用标准氢氧化钠溶液润洗碱式滴定管后再盛入标准碱溶液
B.用待测酸溶液润洗锥形瓶后再盛入待测酸溶液
C.用酚酞作指示剂,滴定终点时溶液颜色由无色变浅红色
D.读数时,视线应与滴定管凹液面的最低点保持水平
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:阅读理解
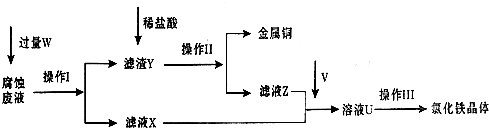
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A.用标准氢氧化钠溶液润洗碱式滴定管后,再盛入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再盛入待测酸溶液
C.用酚酞作指示剂,滴定终点时溶液颜色由无色变为浅红色
D.读数时,视线应与滴定管凹液面的最低点保持水平
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高三下学期5月考前适应性考试化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
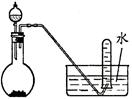

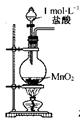
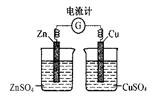
图1 图2 图3 图4
A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置检验电流的方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com