
| A. | ①②③ | B. | ①② | C. | ①③ | D. | ②③ |
科目:高中化学 来源: 题型:实验题
 某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).
某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{15}^{52}$P的原子核中含有15个中子 | |
| B. | ${\;}_{15}^{52}$P的相对原子质量为32 | |
| C. | ${\;}_{15}^{52}$P原子的质量数是17 | |
| D. | ${\;}_{15}^{52}$P原子中含有的电子数和质子数都是15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | Mg SO4 | NaBr |
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
| A. | CaSO4 | B. | MgSO4 | C. | NaCl | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
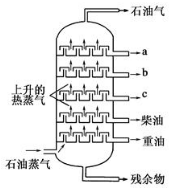
| A. | 在a、b、c三种馏分中,a的熔点最高 | |
| B. | 分馏产品的沸点:a>b>c>柴油>重油 | |
| C. | 在a、b、c三种馏分中,c的平均相对分子质量最大 | |
| D. | a、b、c、柴油、重油都是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 相对原子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
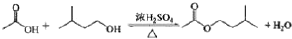
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
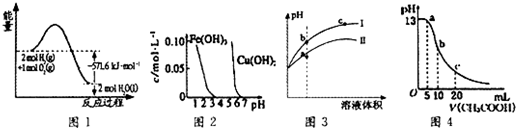
| A. | 图1表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. | 由图2得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. | 图3表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 图4表示常温下向体积为10 mL0.1 mol/LNaOH溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com