
【题目】在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
(1)按电子排布,Q元素在周期表中属区.
(2)第一电离能YZ,电负性YZ(填“>”,“=”或“<”).
(3)W与Z形成的常见化合物有W2Z、W2Z2 , W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6…,W2Z分子中Z原子的杂化类型为 , YW3分子的立体构型为 , YW3极易溶于W2Z的主要原因有 .
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 .
(5)Q+与Y3﹣形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏伽德罗常数用NA 表示,则晶体的密度为gcm﹣3 . 
【答案】
(1)ds
(2)>;<
(3)sp3杂化;三角锥形;都是极性分子,相似相溶;NH3与H2O分子间可形成氢键;NH3与H2O发生反应
(4)配位键、极性键
(5)![]()
【解析】解:(1)核外电子排布式为:1s22s22p63s23p63d104s1 , 所以Q元素在周期表中属ds 区,所以答案是:ds;(2)氮核外电子排布处于半满状态,所以第一电离能Y>Z,同周期从左往右电负性增强,所以电负性Y<Z,所以答案是:>;<;(3)H2O分子中O原子的杂化类型为sp3杂化,NH3分子中N原子的杂化类型为sp3杂化,分子的立体构型为三角锥形,氨气与水分子间存在氢键,所以NH3极易溶于H2O,氨气与水反应生成一水合氨,所以答案是:sp3杂化;三角锥形;都是极性分子,相似相溶;NH3与H2O分子间可形成氢键;NH3与H2O发生反应;(4)硫酸铜溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,[Cu(NH3)4]2+中含有的化学键有配位键、极性键,所以答案是:配位键、极性键(5)Cu+与N3﹣形成的晶胞结构如图所示,则晶胞边长为2acm,该晶胞中灰色球个数=8× ![]() =1、黑色球个数=12×
=1、黑色球个数=12× ![]() =3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3﹣相连的Cu+有6个,该晶体的密度=
=3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3﹣相连的Cu+有6个,该晶体的密度= ![]() =
=  =
= ![]() gcm﹣3 , 所以答案是:
gcm﹣3 , 所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1molL﹣1 NH4NO3溶液中的氮原子数为0.1NA
B.22g N2O所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.将足量铜加入54.3mL 18.4 molL﹣1浓H2SO4中充分反应产生气体的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A. 晶体熔点的高低: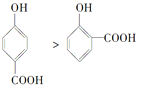
B. 熔点由高到低:Na>Mg>Al
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铁粉反应放出大量氢气,此溶液中可能大量共存的离子组是( )
A.H+、K+、Mg2+、Cl﹣
B.Ba2+、SO ![]() 、Cl﹣、OH﹣
、Cl﹣、OH﹣
C.K+、OH﹣、CO ![]() 、MnO
、MnO ![]() ?
?
D.Ca2+、H+、Cl﹣、HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式为C6H12 , 分子结构中含有3个“﹣CH3”的烯烃共有5种
B.对苯二甲酸( ![]() )与乙二醇(HOCH2CH2OH)不能制取聚酯纤维(
)与乙二醇(HOCH2CH2OH)不能制取聚酯纤维( 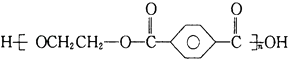 )
)
C.油脂在酸或碱催化条件下可以水解.在酸性条件下的水解反应称为皂化反应,常用此反应来制取肥皂
D.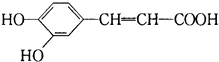 分子中的所有原子一定不可能共平面
分子中的所有原子一定不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用化学用语回答下列问题:
(1)漂白粉的有效成分为 .
(2)标出氢化钠中氢元素的化合价: .
(3)NaHSO4在水中溶解时的电离方程式为 .
(4)工业合成氨的化学方程式为 .
(5)加热饱和FeCl3溶液形成Fe(OH)3胶体的离子方程式为 .
(6)向明矾水溶液中加入过量的氢氧化钡溶液,发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.在常温常压下,1 mol 氦气含有的原子数为NA
C.常温常压下,22.4L氯气与足量金属钠充分反应,转移的电子数为2NA
D.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾拉莫德是目前应用广泛的新型治疗类风湿性关节炎的药物.它的合成路线如下.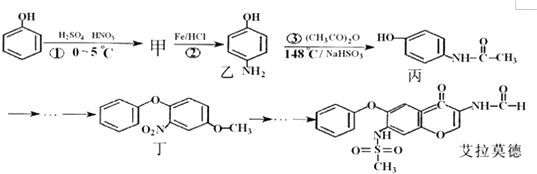
请回答下列问题:
(1)写出艾拉莫德分子结构中的任意两种含氧官能团的名称: .
(2)甲的结构简式为 .
(3)①反应中有一种主要副产物是甲的同分异构体,其结构是 .
(4)③反应温度较高,若不加NaHS03会导致反应混合体系的颜色明显不同,可能的原因 , 完成③反应的化学方程式并注明反应类型: .
(5)艾拉莫德可能具有的性质是(填序号).
A.艾拉莫德易溶于水
B.在一定条件下能与H2发生加成反应
C.能使酸性高锰酸钾溶液褪色
D.因为结构中有 ![]() ,所以它属于二肽
,所以它属于二肽
(6)戊是丙的同分异构体,且满足下列条件:
①含有 ![]() 结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
完成戊与NaOH溶液反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com