


科目:高中化学 来源: 题型:
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探
究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
(2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。
①实验装置的连接顺序为_________________________________。
②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省、庄河高中高三上学期期末联考卷三化学试卷 题型:实验题
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气 体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探
究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
(2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。
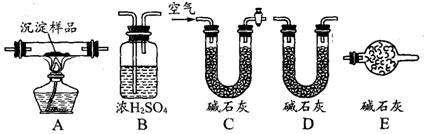
①实验装置的连接顺序为_________________________________。
②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com