
【题目】某烃与氢气发生反应后能生成(CH3)2CHCH2CH3 , 则该烃不可能是( )
A.2﹣甲基﹣2﹣丁烯
B.2,3﹣二甲基﹣1﹣丙烯
C.3﹣甲基﹣1﹣丁烯
D.2﹣甲基﹣1,3﹣丁二烯
【答案】B
【解析】解:(CH3)2CHCH2CH3 , 结构为 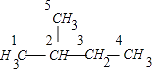 .5号碳原子与1号碳原子化学环境相同. A.若2、3号碳原子各去掉1个H原子,形成的烯烃为2﹣甲基﹣2﹣丁烯,故A不选;
.5号碳原子与1号碳原子化学环境相同. A.若2、3号碳原子各去掉1个H原子,形成的烯烃为2﹣甲基﹣2﹣丁烯,故A不选;
B.若1(或5号)、2号碳原子各去掉1个H原子,形成的烯烃为2﹣甲基﹣1﹣丁烯;若3、4号碳原子各去掉2个H原子,形成的炔烃为3﹣甲基﹣1﹣丁炔,无法得到2,3﹣二甲基﹣1﹣丙烯,故B选;
C.若3、4号碳原子各去掉1个H原子,形成的烯烃为3﹣甲基﹣1﹣丁烯,故C不选;
D.若1、2号碳原子各去掉1个H原子,同时3、4号碳原子各去掉1个H原子,形成的二烯烃为2﹣甲基﹣1,3﹣丁二烯,故D不选;
故选B.
有机物分子中的不饱和键断裂,不饱和原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,采用逆推法,减去相邻碳原子上的氢原子,重新形成不饱和键,即可的原来的不饱和烃,再根据有机物的命名原则进行命名.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2 , 装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是 . 实验中不能用干燥空气代替干燥N2 , 原因是 .
(2)如将装置B改为装置C(图2),可能会导致的后果是 .
(3)步骤3中,第一次过滤除去的物质是 .
(4)有关步骤4的说法,正确的是 .
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:
Mg2++Y4﹣═MgY2﹣
①滴定前润洗滴定管的操作方法是 .
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是(以质量分数表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系一定正确的是( )
A.常温下,pH=9的NaHA溶液:c(Na+)>c(HA﹣)>c(H2A)
B.Na2CO3溶液:c(H+)﹣c(OH﹣)=c(HCO ![]() )+2c(CO
)+2c(CO ![]() )﹣c(Na+)
)﹣c(Na+)
C.向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO﹣)>c(OH﹣)>c(H+)
D.浓度均为0.1mol?L﹣1的HF溶液与KF溶液等体积混合:c(F﹣)+c(HF)=0.2mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+![]() (对苯醌)═N2H4+
(对苯醌)═N2H4+![]() (对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(2)25℃时.将nmolL﹣1的氨水与0.1molL﹣1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl﹣)时.则溶液的pH= .
②当混合溶液中,c(NH4+)>c(Cl﹣)时.则反应的情况可能为 .
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)2NH3(g)△H=bkJmol﹣1 , 其化学平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
①写出该反应的化学平衡常数的表达式: , b(填“大于”、“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=﹣1266.8kJmol﹣1
②N2(g)+O2(g)═2NO(g)△H=180.5kJmol﹣1
写出氨高温催化氧化的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中装有还原剂肼(N2H4 , 又名联氨)和强氧化剂过氧化氢(H2O2),当它们混合时,立即产生大量氮气和水蒸气,并放出大量热.
(1)写出过氧化氢的电子式;肼的结构式;
(2)已知0.4mol液态肼和足量液态过氧化氢反应,生成氮气和水蒸气时放出256.6KJ的热量,写出反应的热化学方程式;
(3)火箭推进器中的氧化剂还可以用NO2代替.已知有以下反应:①N2(g)+2O2(g)═2NO2(g)△H1=+67.7KJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=﹣534KJ/mol
写出肼与NO2反应的热化学方程式;
(4)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.42 g蔗糖与3.24 g淀粉混合并完全水解,若共生成m g葡萄糖和n g果糖,则m:n为( )
A.1:3
B.1:5
C.5:1
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉和纤维素都可以用(C6H10O5)n表示,下列叙述正确的是( )
A.它们都不是混合物
B.它们都不是天然高分子化合物
C.它们是同分异构体
D.它们水解的最终产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃,101kPa下,0.1molC2H2完全燃烧生成CO2和H2O(I)时放出129.96kJ热量.表示上述反应的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+129.96kJ
B.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(g)﹣259.92kJ
C.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)﹣1299.6kJ
D.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2599.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备: 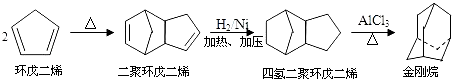
请回答下列问题:
(1)环戊二烯分子中最多有个原子共平面;
(2)金刚烷的分子式为 , 其分子中的CH2基团有个;其二氯取代物有种.
(3)下面是以环戊烷为原料制备环戊二烯的合成路线: 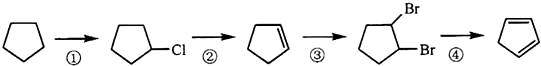 其中,反应③的反应类型是 .
其中,反应③的反应类型是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com