
| 晶体 | NaCl | MgO | AlBr3 | SiCl4 | 共价化合物R |
| 熔点(℃) | 801 | 2852 | 97.5 | -70 | 1723 |
| 沸点(℃) | 1413 | 3600 | 263.3 | 57 | 2230 |
| A. | SiCl4是分子晶体 | B. | MgO比NaCl的晶格能大 | ||
| C. | R是原子晶体 | D. | AlBr3为离子晶体 |
分析 分子晶体熔沸点较低,离子晶体熔沸点较高,原子晶体熔沸点很高,晶格能与离子半径成反比,与离子所带电荷成正比,据此分析解答.
解答 解:A.分子晶体熔沸点较低,根据表中数据知,SiCl4的熔沸点较低,为分子晶体,故A正确;
B.晶格能与离子半径成反比,与离子所带电荷成正比,镁离子、氧离子所带电荷大于钠离子、氯离子,而半径小于钠离子、氯离子,所以晶格能MgO>NaCl,故B正确;
C.原子晶体熔沸点很高,根据表中数据知,R是原子晶体,故C正确;
D.分子晶体熔沸点较低,根据表中数据知,AlBr3熔沸点较低,为分子晶体,故D错误;
故选D.
点评 本题考查晶体类型判断及晶格能大小比较,为高频考点,明确晶体类型与物质熔沸点关系、晶格能大小影响因素即可解答,晶格能与离子半径成反比,与离子所带电荷成正比.


科目:高中化学 来源: 题型:选择题
| A. | 五氧化二磷只是磷酸的酸酐 | |
| B. | 二氧化氮不是硝酸的酸酐 | |
| C. | 安全火柴盒的侧面所涂的物质是一种混合物,其中含有红磷和三硫化二锑等 | |
| D. | 含磷的废水拍到自然水中,能引起藻类增殖,使水变质,必须除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b=10 mL | B. | a=b>10 mL | C. | a<b | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| C | 将乙醇与浓硫酸共热产生气体直接通入酸性KMnO4溶液 | 检验乙烯的生成 |
| D | 向AgCl沉淀中滴加少量KI溶液,观察到白色沉淀转化为黄色沉淀 | 验证Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
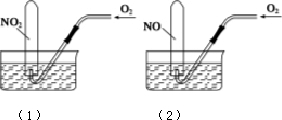 如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )
如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )| A. | 1:1 | B. | 5:7 | ||
| C. | 7:5 | D. | 4:3 (1)(2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com