
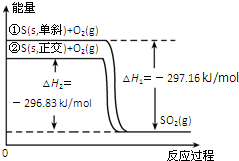
| A. | 单斜硫转化为正交硫的反应是吸热反应 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①表示断裂1mol O2中的共价键所吸收的能量比形成lmolSO2中的共价键所放出的能量少297.16 kJ |
分析 由图象可以看出,单斜硫的能量比正交硫的能量高,物质的能量越高越不稳定,生成SO2的反应为放热反应,以此解答该题.
解答 解:A.单斜硫的能量比正交硫的能量高,二者转化热化学方程式为:S(s,单斜)=S(s,正交)△H=-0.33kJ/mol,该反应为放热反应,故A错误;
B.物质的能量越高越不稳定,则正交硫比单斜硫稳定,故B正确;
C.由图象可以看出,单斜硫的能量比正交硫的能量高,故C错误;
D.①式反应需断裂单斜硫中S-S键和O=O键,不仅仅是断裂lmolO2中的共价键所吸收的能量,故D错误;
故选B.
点评 本题考查化学反应与能量的变化,题目难度不大,注意分析能量曲线,判断反应热、活化能与键能的关系,试题培养了学生的灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 3NO2+H2O═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
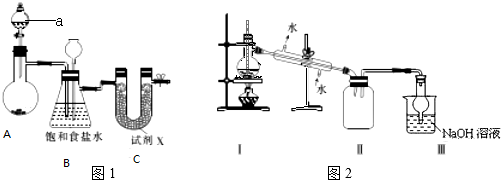
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
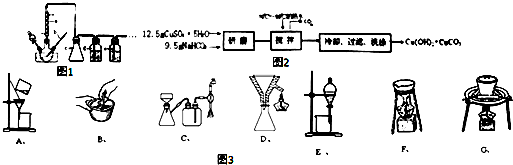
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 )原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)原料,制取苯甲酸甲酯,已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
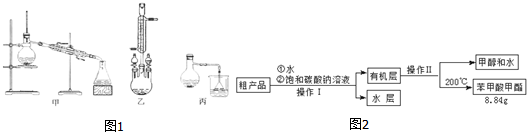
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| C. | SO2的水溶液能够导电,所以SO2是电解质 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需加热的反应是吸热反应 | B. | 只有分解反应才是吸热反应 | ||
| C. | 使用催化剂的反应是吸热反应 | D. | 氧化还原反应不一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| D. | 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com