
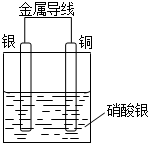
 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
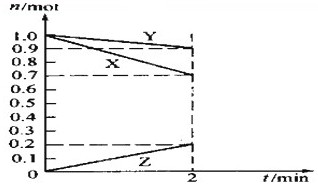 (1)反应A+3B=2C+2D在四种不同情况下的反应速率分别为
(1)反应A+3B=2C+2D在四种不同情况下的反应速率分别为查看答案和解析>>
科目:高中化学 来源: 题型:
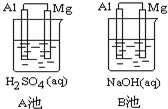 Al-Mg在不同的电解质溶液中分别构成原电池A、B.如图所示:
Al-Mg在不同的电解质溶液中分别构成原电池A、B.如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2,则线段BC表示
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2,则线段BC表示查看答案和解析>>
科目:高中化学 来源: 题型:
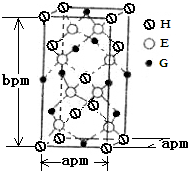 A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:
A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCN |
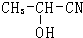
| HCl |
| H2O |
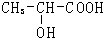
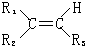
| ①O5 |
| ②Zn/H2O |
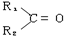 +
+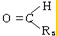
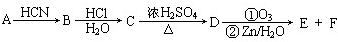
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、离子半径大小:r(M3+)>r(T2-) |
| B、R的氧化物对应的水化物不可能具有两性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、L、T形成的简单离子核外电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com