
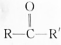 结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.
结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式. 分析 化合物A、B、C,分子式均为C4H6,说明它们不饱和度为2,常温下它们都能使识溴的CCL4溶液腿色,说明都有不饱和键,当使用等摩尔数的样品与溴反应时,B和C所需的溴量是A的2倍,说明B和C的双键的数目是A的2倍,则A为环烯,B和C为二烯烃或炔烃,它们都能与HBr充分反应,而B与C得到的是同一化合物;B与C能与含HgSO4的稀硫酸反应生成同一种酮(含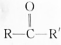 结构),则B和C均为炔,B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应,则B中碳碳参键在边上,而C中碳碳参键在中间,据此答题.
结构),则B和C均为炔,B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应,则B中碳碳参键在边上,而C中碳碳参键在中间,据此答题.
解答 解:化合物A、B、C,分子式均为C4H6,说明它们不饱和度为2,常温下它们都能使识溴的CCL4溶液腿色,说明都有不饱和键,当使用等摩尔数的样品与溴反应时,B和C所需的溴量是A的2倍,说明B和C的双键的数目是A的2倍,则A为环烯,所以A为 ,B和C为二烯烃或炔烃,它们都能与HBr充分反应,而B与C得到的是同一化合物;B与C能与含HgSO4的稀硫酸反应生成同一种酮(含
,B和C为二烯烃或炔烃,它们都能与HBr充分反应,而B与C得到的是同一化合物;B与C能与含HgSO4的稀硫酸反应生成同一种酮(含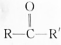 结构),则B和C均为炔,B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应,则B中碳碳参键在边上,而C中碳碳参键在中间,所以B为CH≡CCH2CH3,C为CH3C≡CCH3,
结构),则B和C均为炔,B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应,则B中碳碳参键在边上,而C中碳碳参键在中间,所以B为CH≡CCH2CH3,C为CH3C≡CCH3,
答:A为 ,B为CH≡CCH2CH3,C为CH3C≡CCH3.
,B为CH≡CCH2CH3,C为CH3C≡CCH3.
点评 本题考查有机物推断,侧重考查学生的分析推理能力,需要学生熟练掌握不饱和烃的结构和性质,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应都是吸热反应 | |
| B. | 已知1mol CO(g)完全燃烧时放出283.0kJ热量,则表示CO(g)燃烧热的热化学方程式为 2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ/mol | |
| C. | △H<0、△S<0的反应肯定是自发的 | |
| D. | 任何化学反应都有反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度大小:硝基苯>水>苯 | |
| B. | 熔、沸点高低:乙醇>丁烷>丙烷 | |
| C. | 含碳量大小:乙烷>乙醇>乙酸 | |
| D. | 等质量燃烧时的耗氧量:乙烷>乙烯>丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ K+ OH- Cl- | B. | Na+ Fe3+ SO42- NO3- | ||
| C. | Mg2+ Na+ SO42- Cl- | D. | Ba2+ HCO3- NO3- K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| 键能(KJ•mol-1) | 436 | 326 | 803 | 464 | 414 |
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H(g)+Cl(g)═HCl(g)△H=-431kJ•mol-1 | |
| B. | 2HCl(g)═H2(g)+Cl2(g)的反应热△H<0 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ | |
| D. | 相同条件下,H2(g)+Cl2(g)═2HCl(g)反应在光照和点燃条件下的△H不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com