
| A. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 | |
| B. | 麦芽糖和蔗糖互为同分异构体 | |
| C. | 淀粉遇碘化钾溶液变蓝 | |
| D. | 糖类不一定都能水解 |
分析 A.葡萄糖属于单糖,蔗糖属于糖类中的二糖,二者组成通式不同,结构不相似;
B.同分异构体是分子式相同结构式不同的化合物;
C.淀粉遇碘单质变蓝色;
D.单糖不水解,双糖、多糖能水解.
解答 解:A.葡萄糖属于单糖,分子式为C6H12O6,蔗糖属于糖类中的二糖,分子式为C12H22O11,二者组成通式不同,结构不相似,不是同系物,故A正确;
B.蔗糖和麦芽糖分子式相同,为C12H22O11,结构不同,互为同分异构体,故B正确;
C.淀粉遇碘单质变蓝色,而不是碘离子,故C错误;
D.单糖属于小分子不水解如葡萄糖,双糖、多糖能水解生成单糖,故D正确;
故选C.
点评 本题考查了有机物的组成和性质,侧重糖有关知识的考查,为高频考点,注意相关基础知识的积累,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 纤维素的葡萄糖单元中含有羟基 | |
| B. | 氨基酸分子中既有氨基,又有羧基,属于两性化合物 | |
| C. | CH3CO18OH和C2H5OH发生酯化反应的有机产物是CH3CO18OC2H5 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸(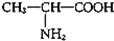 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成尿酸钠晶体的反应为放热反应 | B. | 形成尿酸钠晶体的反应为吸热反应 | ||
| C. | 尿酸钠溶液呈酸性 | D. | 尿酸钠晶体一定难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 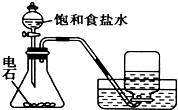 实验室制取乙炔 | B. | 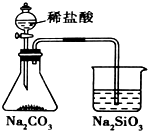 能证明非金属性Cl>C>Si | ||
| C. | 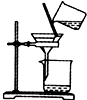 分离出Cl2与KI溶液反应生成的碘 | D. | 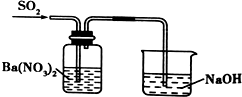 洗气瓶中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
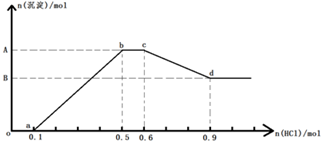
| A. | 原溶液中n(Na+)=0.6mol | B. | 原溶液中n(AlO2-)=0.3mol | ||
| C. | A点对应的沉淀物质的量为0.2mol | D. | bc段的反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
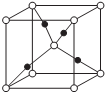 X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
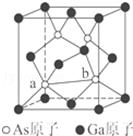 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com