
酸碱中和滴定是应用最多的滴定。现在以酚酞为指示剂,用已知浓度的NaOH溶液去滴定一定体积、未知浓度的HCl溶液。
(1)在滴定中,若实验操作不当会导致实验误差。下列操作会使实验结果偏高的是 。
①酸式滴定管洗涤后没有用待测液润洗
②碱式滴定管洗涤后没有用标准液润洗
③在滴定过程中,向锥形瓶中添加蒸馏水
④待测液从锥形瓶中溅出
⑤滴定过程中起始读数时俯视,终点后读数时仰视
(2)在滴定管使用时首先应该进行的操作是_______________________,滴定过程中左手控制滴定管,右手旋摇锥形瓶,眼睛注视锥形瓶中溶液颜色变化,达到滴定终点的现象是:______________________。
(1)②⑤(2分,答对一个给1分);
(2)检查是否漏水(1分);无色变为浅红色,且半分钟不褪色(2分)
解析试题分析:(1)根据c(待)=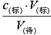 判断不当操作对相关物理量的影响。①酸式滴定管洗涤后没有用待测液润洗,则盐酸的浓度被稀释,从而导致V(标)减小,测定结果偏低,①不正确;②碱式滴定管洗涤后没有用标准液润洗,则氢氧化钠溶液的浓度减小,从而导致V(标)增大,测定结果偏高,②正确;③在滴定过程中,向锥形瓶中添加蒸馏水,对V(标)无影响,根据c(待)=
判断不当操作对相关物理量的影响。①酸式滴定管洗涤后没有用待测液润洗,则盐酸的浓度被稀释,从而导致V(标)减小,测定结果偏低,①不正确;②碱式滴定管洗涤后没有用标准液润洗,则氢氧化钠溶液的浓度减小,从而导致V(标)增大,测定结果偏高,②正确;③在滴定过程中,向锥形瓶中添加蒸馏水,对V(标)无影响,根据c(待)=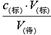 可知,c(待)不变,③不正确;④待测液从锥形瓶中溅出,则导致V(标)减小,根据c(待)=
可知,c(待)不变,③不正确;④待测液从锥形瓶中溅出,则导致V(标)减小,根据c(待)= 可知,c(待)偏小,④不正确;⑤滴定过程中起始读数时俯视,则读数偏小,终点后读数时仰视,则读数偏大,因此导致V(标)增大,根据c(待)=
可知,c(待)偏小,④不正确;⑤滴定过程中起始读数时俯视,则读数偏小,终点后读数时仰视,则读数偏大,因此导致V(标)增大,根据c(待)=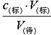 可知,c(待)偏高,⑤正确,答案选②⑤。
可知,c(待)偏高,⑤正确,答案选②⑤。
(2)在滴定管使用时首先应该进行的操作是检查滴定管是否漏水;滴定过程中左手控制滴定管,右手旋摇锥形瓶,眼睛注视锥形瓶中溶液颜色变化。酸不能使酚酞试液变色,碱能使酚酞试液变红色,所以达到滴定终点的现象是无色变为浅红色,且半分钟不褪色。
考点:考查中和滴定实验误差分析以及滴定操作


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:问答题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: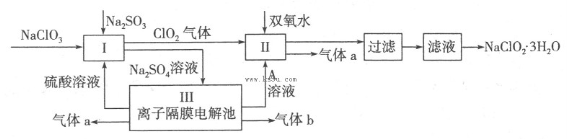
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用 式滴定管盛装c mol/L盐酸标准液。如图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积 mL。
②下表是4种常见指示剂的变色范围: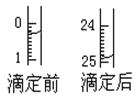
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0—8.0 | 3.1—4.4 | 4.4—6.2 | 8.2—10.0 |
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | | | |
| 3 | V | 6.00 | 31.35 | 25.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
B、用待测定的溶液润洗碱式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a. 滴定操作的正确顺序是(用序号填写)___________________________ 。
b. 在G操作中如何确定终点? __________________________ ____ 。
c. 若换酚酞做指示剂,如何确定终点? _________________________ ____ 。
(2)氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL)[来 | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。
(3)该厂结合本厂实际,选用的X为 (填序号),中和I使溶液中的 (填离子符号)的浓度减小。
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示装置中,a?b都是惰性电极,通电一段时间后(电解液足量),a极附近溶液显红色?下列说法正确的是
| A.a是负极,b是正极 |
| B.CuSO4溶液的pH逐渐减小 |
C.铜电极上的反应式为 |
| D.向NaCl溶液中加入一定量的盐酸,能使溶液与原来溶液完全一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于如图所示的原电池,下列说法正确的是 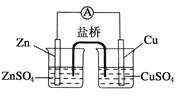
| A.锌电极发生还原反应,铜电极发生氧化反应 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.电子从锌电极通过电流计流向铜电极 |
| D.铜电极上发生的电极反应为2H++2e-===H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关金属铁的腐蚀与防护,说法正确的是
| A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.铁与电源正极连接可实现电化学保护 |
| D.将钢管与铜管一起堆放时可保护钢管少受腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com