
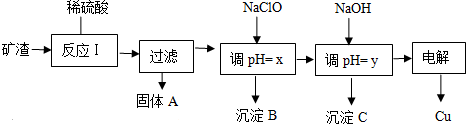
|
| 10-14 |
| 10-8 |


科目:高中化学 来源: 题型:
A、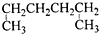 1,4-二甲基丁烷 |
B、 3-甲基丁烯 |
C、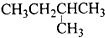 2-甲基丁烷 |
D、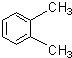 对二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、23gNa变为Na+时失去的电子数为NA |
| B、17g OH-所含的电子数为9NA |
| C、标准状况下,11.2LNH3所含的分子数目为0.5NA |
| D、含71g Na2SO4的溶液中所含Na+离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与盐酸反应:Al+6H+═Al3++3H2↑ |
| B、CO2通入足量NaOH溶中:CO2+2OH-═CO32-+H2O |
| C、澄清石灰水与盐酸反应:Ca(OH)2+2H+═2H2O+Ca2+ |
| D、碳酸钠与氯化钙混合:Na2CO3+Ca2+═CaCO3↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一种纯净的化合物 |
| B、一种单质和一种化合物的混合物 |
| C、两种化合物的混合物 |
| D、两种单质的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2:2 |
| B、1:3:3 |
| C、2:3:6 |
| D、3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )
,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )| A、使用了过量的氧化剂 |
| B、没有用乙酸,而是使用了其它催化剂 |
| C、把反应混合物加热 |
| D、所生成的甲萘醌是沉淀物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com