
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
| 足量的钠 |

查看答案和解析>>
科目:高中化学 来源: 题型:
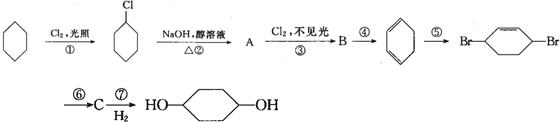
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- OH- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | 浓度c/(mol?L-1) |
| ① | |
| ② | |
| ③ | |
| ④ | |
| ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol?L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol?L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol?L-1?s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
| A、0.0380 mol?L-1?s-1 |
| B、0.152 mol?L-1?s-1 |
| C、0.608 mol?L-1?s-1 |
| D、0.760 mol?L-1?s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com