
| A. | 电解饱和食盐水制取氢气 | |
| B. | 大量设立水电站,用电力分解水制取氢气. | |
| C. | 设法将太阳能聚焦,产生高温,使水分解产生氢气. | |
| D. | 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气. |
分析 以水为原料制取氢气,需要消耗另一种能源,如水力,化石燃料等,而且这些能源都比较紧缺.而利用太阳能在某种催化剂作用下分解水是最好的,太阳能环保无污染,且取之不尽用之不竭.
解答 解:因为“电解饱和食盐水制取氢气;大量建设水电站,用电力分解水制取氢气;找更多的化石燃料,利用其燃烧放热,使水分解产生氢气”,在这些过程中,都要消耗另一种能源,也会对环境造成污染,而且这些能源都比较紧缺.而利用太阳能在某种催化剂作用下分解水,太阳能环保无污染,且资源相当丰富,取之不尽用之不竭.
故选C.
点评 本题考查使用化石燃料的利弊及新能源的开发,解答本题要分析用水制二级能源氢气是否廉价、是否容易操作,是否可行,只有这样才能对相关方面的问题做出正确的判断,难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
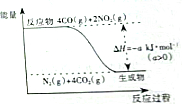 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应的特征是正反应速率和逆反应速率相等 | |
| B. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 | |
| C. | 在其他条件不变时,升高温度可以使平衡向正反应方向移动 | |
| D. | 对于反应A(g)+3B(g)?2C(g)△H<0达平衡后,温度降低,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
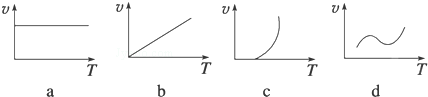
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
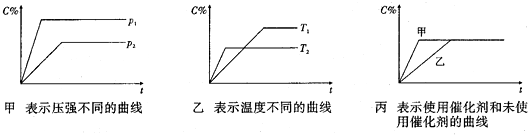

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


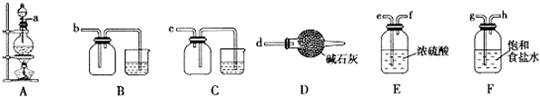
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸 | |
| B. | 浓硫酸具有吸水性,故能使蔗糖碳化 | |
| C. | 浓硫酸和铜片加热既表现出酸性,又表现出氧化性 | |
| D. | 浓H2SO4可做H2、O2等气体的干燥剂表现其脱水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com