
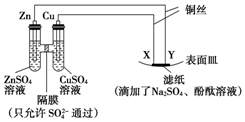
| A. | X为正极,发生氧化反应 | B. | Y与滤纸接触处有氧气生成 | ||
| C. | X为阳极,发生氧化反应 | D. | X与滤纸接触处变红 |
分析 左边装置能自发的进行氧化还原反应为原电池,易失电子的锌作负极,铜作正极,则X是阳极,Y是阴极,活泼金属作电解池阳极时,阳极上金属失电子发生氧化反应,阳极上电极反应为Cu-2e-=Cu2+、阴极电极反应式为2H2O+2e-=2OH-+H2↑,以此解答该题.
解答 解:A.X连接原电池正极,为电解池阳极,阳极上失电子发生氧化反应,故A错误;
B.Y连接原电池负极,为电解池阴极,阴极上得电子发生还原反应,电极反应式为2H2O+2e-=2OH-+H2↑,则Y与滤纸接触处有氢气生成,故B错误;
C.X连接原电池正极,为电解池阳极,阳极上失电子发生氧化反应,故C正确;
D.X为电解池阳极,阳极上铜电极失电子发生氧化反应而生成铜离子,所以不可能生成氢氧根离子,则X与滤纸接触处不可能变红,故D错误;
故选C.
点评 本题考查了原电池和电解池原理,正确判断原电池和电解池是解本题关键,再结合各个电极上发生的电极反应来分析解答即可,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子的能量不变 | B. | 增加了活化分子的百分数 | ||
| C. | 降低了反应的活化能 | D. | 改变了化学反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: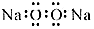 | B. | 次氯酸钠的结构式:H-Cl-OC | ||
| C. | 氯化铵的电子式: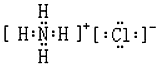 | D. | 硫离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 4 | 8 | 12 | 16 | 20 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
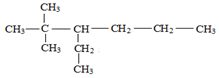 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.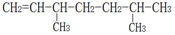 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.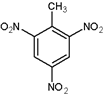 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com