
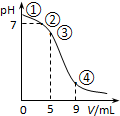
 25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol•L-1 | |
| C. | 点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
分析 A.点①时为醋酸钠溶液,根据醋酸钠溶液中的质子守恒判断;
B.点②溶液的pH=7,加入盐酸的体积小于10mL,根据物料守恒分析;
C.点③所示溶液中,加入5mL盐酸,此时溶质为等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解,溶液显示酸性;
D.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断.
解答 解:A.点①所示溶液为醋酸钠溶液,根据醋酸钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(CH3COOH),故A正确;
B.点②所示溶液中,根据物料守恒可得:n(CH3COOH)+n(CH3COO-)=0.001mol,由于加入的盐酸小于5mL,则混合液总体积小于20mL,所以c(CH3COOH)+c(CH3COO-)>0.05 mol•L-1,故B错误;
C.点③所示溶液中,反应后溶质为等浓度的醋酸和醋酸钠,溶液显示酸性,则:c(H+)>c(OH-),由于醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),所以溶液中离子浓度关系为:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),故C正确;
D.任何溶液中一定满足电荷守恒,根据混合液中的电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),故c(Na+)+c(H+)>c(CH3COO-)+c(Cl-),故D错误;
故选AC.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,注意掌握判断离子浓度大小常用方法,如:电荷守恒、物料守恒、质子守恒、盐的水解原理等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
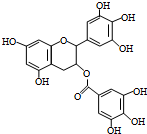 绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )
绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | 1mol EGCG最多可与含9mol NaOH的溶液反应 | |
| C. | EGCG在空气中易被氧化,不能与溴水发生加成反应 | |
| D. | EGCG不能与Na2CO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 L H2O中含有极性共价键的数目为0.2 NA | |
| B. | 0.1 mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA | |
| C. | 100 mL 12 mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的正戊烷所含的分子数为0.5NA | |
| B. | 1 mol甲基中的电子数目为9NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数目为NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA | |
| D. | 1molMg变为Mg2+时失去电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究小组探究:
某研究小组探究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com