
| A. | ①④ | B. | ②③ | C. | ①② | D. | ③④ |
分析 首先要根据高聚物的结构简式判断高聚物是加聚产物还是缩聚产物,然后根据推断单体的方法作出判断,
加聚产物的单体推断方法:凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合即得单体,凡链节中主碳链为6个碳原子,含有碳碳双键结构,单体为两种(即单烯烃和二烯烃).
缩产物的单体推断方法:断键,补原子.即找到断键点,断键后在相应部位加上-OH或-H,以此解答该题.
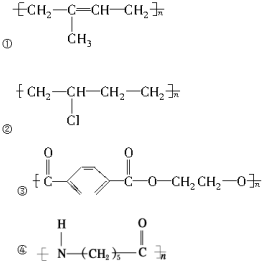
解答 解:①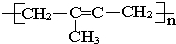 为加聚反应产物,其单体为:
为加聚反应产物,其单体为: ,名称为:2-甲基-1,3-丁二烯,单体只有一种物质,故①正确;
,名称为:2-甲基-1,3-丁二烯,单体只有一种物质,故①正确;
②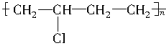 ,为加聚反应产物,其单体为乙烯、氯乙烯两种物质,故②错误;
,为加聚反应产物,其单体为乙烯、氯乙烯两种物质,故②错误;
③ ,为缩聚反应产物,其单体为乙二醇和对二苯甲酸,故③错误;
,为缩聚反应产物,其单体为乙二醇和对二苯甲酸,故③错误;
④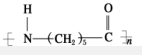 ,为缩聚反应产物,其单体为NH2(CH2)5COOH,单体只有一种物质,故④正确;
,为缩聚反应产物,其单体为NH2(CH2)5COOH,单体只有一种物质,故④正确;
故选A.
点评 本题考查有机物的结构和性质,侧重于考查根据聚合反应产物判断其单体的方法,题目难度中等,解题根据是明确高分子化合物为加聚反应还是缩聚反应产物,然后根据反应特点找出单体即可.


科目:高中化学 来源: 题型:选择题
| A. | 氯化氢是白色有刺激性气味的气体 | |
| B. | 氯化氢具有强酸性 | |
| C. | 氯化氢能使干燥的蓝色石蕊试纸变红 | |
| D. | 氯化氢极易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
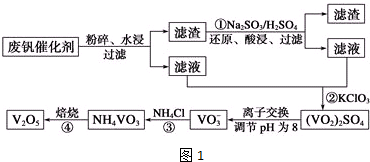
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
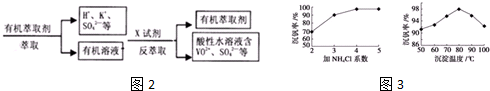
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | a中试剂 | b中试剂 | 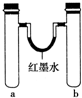 |
| 1 | 0.1g Na、3mL水 | 0.1g Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaHCO3溶液中:K+、Cl-、AlO2-、SO42- | |
| B. | 加入铝粉能产生H2的溶液中:Na+、Fe3+、Cl-、NO3- | |
| C. | c(OH-)/c(H+)=1012的溶液中:SO32-、NO3-、K+ | |
| D. | 含有大量MnO4-的溶液中:H+、Ca2+、K+、Cl-、C2O42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气可供人呼吸但会使食物变质 | |
| B. | 化肥能促进植物生长但会污染土壤 | |
| C. | 一氧化碳可用于冶炼金属但会使人中毒 | |
| D. | 二氧化碳能灭火但会造成酸雨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com