
| A. | 标准状态下,22.4L氯化氢中含有氯原子的数目为NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有碳原子的数目为NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
分析 A.标准状况下气体物质的量n=$\frac{V}{22.4}$mol,计算HCl分子中氯原子数;
B.根据乙烯和丙烯的最简式计算出含有的碳原子的物质的量及数目;
C.根据铜足量,浓硫酸变成稀硫酸,稀硫酸与铜不反应进行分析;
D.根据合成氨的反应是可逆反应进行分析.
解答 解:A.标准状态下,22.4L氯化氢物质的量=$\frac{22.4L}{22.4l/mol}$=1mol,1molHCl中含有氯原子的数目为NA,故A正确;
B、乙烯和丙烯的最简式为CH2,7.0g混合气体含有CH2物质的量=$\frac{7g}{14g/mol}$=0.5mol,含有0.5mol碳原子,含有碳原子的数目为0.5NA,故B错误;
C、50mL18.4mol/L浓硫酸中含有0.92mol硫酸,浓硫酸完全反应生成0.46mol二氧化硫,由于铜足量,浓硫酸反应后变成稀硫酸,稀硫酸与铜不反应,故生成SO2分子的数目小于0.46NA,故C错误;
D、由于氮气与氢气生成氨气的反应是可逆反应,0.1molN2和0.3molH2不可能完全转化成0.2mol氨气,因此转移电子的数目小于0.6NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数应用,注意标准状况下的物质状态,注意可逆反应不可能完全转化,题目难度不大.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
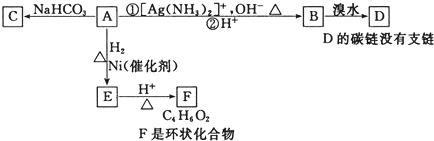
| A. | 化合物A中一定含有的官能团是醛基、羧基和碳碳双键 | |
| B. | 由A生成E发生还原反应 | |
| C. | F的结构简式可表示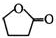 | |
| D. | 由B生成D发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,丁烷是气体 | |
| B. | 丁烷与甲烷互为同系物 | |
| C. | 丁烷有正丁烷和异丁烷两种同分异构体 | |
| D. | 戊烷进行一氯取代后生成两种沸点不同的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高级脂肪酸甘油酯的碱性水解叫皂化反应 | |
| B. | 含淀粉或纤维素的物质可以酿酒 | |
| C. | 鸡蛋清的溶液中加入饱和氯化钠溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L甲苯所含的分子数约为NA | |
| B. | 室温下,2.8g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| C. | 1 mol C30H62分子中含有共价键的数目为92NA | |
| D. | 1 mol氯气和足量甲烷在光照条件下反应可生成2NA个氯化氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 从结构的角度可以帮助我们更好的理解有机物的化学性质.
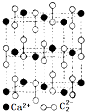
从结构的角度可以帮助我们更好的理解有机物的化学性质.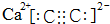 ,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3
,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3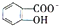 判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是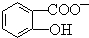 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com