
【题目】25℃时,向20mL0.0100mol/L苯酚(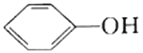 )溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
)溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是

A. 25℃时,苯酚的电离常数Ka约为1.0×10-4
B. M点时,所加人NaOH溶液的体积大于10mL
C. M点时,溶液中的水不发生电离
D. 加入20mLNaOH溶液时,溶液中c(OH-)-c(H+)=2c(Na+)-2c(![]() )-c(
)-c(![]() )
)
【答案】D
【解析】
A.由图像中的信息可知0.01molL-1的苯酚溶液的pH=6,则c(![]() )≈c(H+)=10-6mol·L-1,根据苯酚的电离平衡常数表达式进行计算
)≈c(H+)=10-6mol·L-1,根据苯酚的电离平衡常数表达式进行计算![]() ,故A错误;B.当NaOH溶液的体积等于10mL时,相当于溶液中的苯酚钠和苯酚的物质的量相等,又知道苯酚钠的水解程度大于苯酚的电离程度,所以溶液会显碱性,那么M点对应pH=7的溶液加入的NaOH溶液的体积小于10mL,故B错误;C.水的电离是始终存在的,故C错误;D.加入20mLNaOH溶液时存在物料守恒c(Na+)=c(
,故A错误;B.当NaOH溶液的体积等于10mL时,相当于溶液中的苯酚钠和苯酚的物质的量相等,又知道苯酚钠的水解程度大于苯酚的电离程度,所以溶液会显碱性,那么M点对应pH=7的溶液加入的NaOH溶液的体积小于10mL,故B错误;C.水的电离是始终存在的,故C错误;D.加入20mLNaOH溶液时存在物料守恒c(Na+)=c(![]() )+c(
)+c(![]() ),同时存在电荷守恒c(Na+)+c(H+)=c(
),同时存在电荷守恒c(Na+)+c(H+)=c(![]() )+c(OH-),两个等式联立可以得到c(OH-)-c(H+)=2c(Na+)-2c(
)+c(OH-),两个等式联立可以得到c(OH-)-c(H+)=2c(Na+)-2c(![]() )-c(
)-c(![]() ),故D正确。
),故D正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三草酸合铁(III)酸钾K3[Fe(C204)3]·3H2O为绿色晶体,易溶于水,难溶于乙醇丙酮等有机溶剂。
I.三草酸合铁(III)酸钾晶体的制备
①将5g(NH4)2Fe(S04)2·6H2O晶体溶于20mL水中,加入5滴6mol/LH2SO4酸化,加热溶解,搅拌下加入25m饱和和H2C2O4溶液,加热,静置,待黄色的Fe C2O4沉淀完全沉降以后,倾去上层清液,倾析法洗涤沉定2--3次。
②向沉淀中加入10mL饱和草酸钾容液,水浴加热至40℃,用滴管缓慢滴加12mL5%H2O2,边加边搅拌并维持在40℃左右,溶液变成绿色并有棕色的沉淀生成。
③加热煮沸段时间后,再分两批共加入8mL饱和H2C2O4溶液(先加5mL,后慢慢滴加3mL)此时棕色沉淀溶解,变为绿色透明溶液。
④向滤液中缓慢加入10mL95%的乙醇,这时如果滤液浑浊可微热使其变清,放置暗处冷却,结晶完全后,抽滤,用少量洗条剂洗涤晶体两次抽干,干燥,称量,计算产率。
已知制各过程中涉及的主要反应方程式如下:
②6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3
步骤③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
请回答下列各题:
(1)简达倾析法的适用范围____________。
(2)步骤③加热煮沸的目的是___________。
(3)步骤④中乙醇要缓慢加入的原因是_________。
(4)下列物质中最适合作为晶体洗涤剂的是_______(填编号)。
A.冷水 B.丙酮 C.95%的乙醇 D.无水乙醇
(5)如图装置,经过一系列操作完成晶体的抽滤和洗涤。请选择合适的编号,按正确的顺序补充完整(洗条操作只需要考虑一次):开抽气泵→a→____→b→d→c→关闭抽气泵。
a.转移固体混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
II.纯度的测定
称取1.000g产品,配制成250mL溶液,移取25.00mL溶液,酸化后用标定浓度为0.0100 mol/L 的高锰酸钾溶被滴定至终点,三次平行实验平均消耗高猛酸钾溶被24.00 mL。
(6)滴定涉及反应的离子方程式:____________。
(7)计算产品的纯度______(用质量百分数表示)。(K3[Fe(C204)3]·3H2O的相对分子质量为491)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种重要的氧化剂,实验室常用钙单质与氧气在加热条件下反应来制备。下列说法错误的是
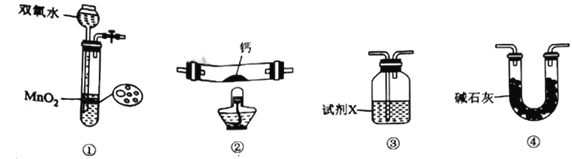
A. 装置①可用于制备氧气
B. 点燃装置②处酒精灯之前,应先排尽装置中的空气
C. 若装置③用于干燥氧气,试剂X可用浓硫酸
D. 装量④可用装置③代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种具有强还原性的一元弱酸,工业上常利用H3PO2和AgNO3溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中不正确的是( )
A. H3PO2中磷元素的化合价为+1 B. H3PO2的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
C. H3PO2被AgNO3氧化成了H3PO4 D. NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,有类似氨的性质。已知:25℃时,Kb1=10-4.07Kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误的是
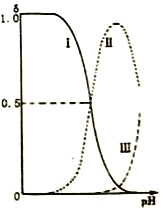
A. H2NCH2CH2NH2在水溶液中第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-
H2NCH2CH2NH3++OH-
B. 曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+
C. 曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07
D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若下图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。
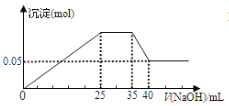
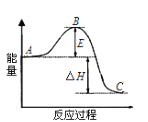
① ②
下列各表述与示意图一致的是( )
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图②中曲线表示某反应过程的能量变化, 若使用催化剂,B点会降低
C. 图①中使用的NaOH的浓度为2 mol/L
D. 图②中物质A反应生成物质C,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
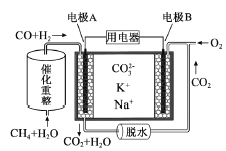
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com