
| A. | 已达平衡状态 | B. | V正>V逆 | ||
| C. | 未达平衡状态,平衡逆向移动 | D. | 无法确定是否达到平衡状态 |
分析 1000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=0.0059,即K=$\frac{c({H}_{2})}{c({H}_{2}O)}$=0.0059,当水蒸气和氢气的物质的量浓度相等时,可知Qc=$\frac{c({H}_{2})}{c({H}_{2}O)}$=1,即K<Qc,以此来解答.
解答 解:1000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=0.0059,即K=$\frac{c({H}_{2})}{c({H}_{2}O)}$=0.0059,当水蒸气和氢气的物质的量浓度相等时,可知Qc=$\frac{c({H}_{2})}{c({H}_{2}O)}$=1,即K<Qc,可知平衡逆向移动,V正<V逆,只有C符合,
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握K的表达式及Qc 的计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意利用K与Qc判断反应的进行方向,题目难度不大.


科目:高中化学 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①③④②⑥⑤ | D. | ①③②④⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C16H22O5 | B. | C14H16O4 | C. | C14H18O5 | D. | C14H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Ba2+、NO3-、Cl- | B. | K+、Na+、OH-、NO3- | ||
| C. | H+、Ag+、Cl-、SO42- | D. | Cu2+、Ca2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液存放在橡皮塞的试剂瓶中 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体和浊液 | |
| D. | 向石蕊试液中加入新制氯水,石蕊试液只变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +99.7kJ•mol-1 | B. | +29.7kJ•mol-1 | C. | -20.6kJ•mol-1 | D. | -241.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
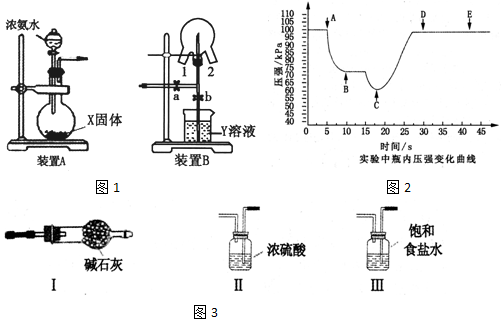
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com