

分析 (1)加入药品a,a为Ca(OH)2,Al3+、Fe3+生成沉淀而被除去;操作①为分离固体和溶液B的过滤,需要玻璃棒引流;Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③防止溶液吸收空气中CO2,
(3)操作2为蒸发浓缩、降温结晶,得到CaCl2;需要用到蒸发皿、玻璃棒、酒精灯、铁架台等仪器;
(4)①样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(CaCl2)=$\frac{1}{2}$n(AgCl)=$\frac{1}{2}$×0.05000mol•L-1×0.02039L×10=0.0050975mol,所以m(CaCl2)=0.0050975mol×111g/mol=0.5658g,则有:$\frac{0.5658g}{0.5800g}$×100%=97.6%.
解答 解:(1)加入药品a,a为Ca(OH)2,Al3+、Fe3+生成沉淀而被除去;操作①为分离固体和溶液B的过滤,需要玻璃棒引流;Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,
故答案为:Ca(OH)2;引流;取溶液B中的少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③防止溶液吸收空气中CO2,
故答案为:将溶液中的少量Ca(OH)2转化为CaCl2;防止Ca2+在蒸发时水解;防止溶液吸收空气中CO2;
(3)操作2为蒸发浓缩、降温结晶,得到CaCl2;需要用到蒸发皿、玻璃棒、酒精灯、铁架台等仪器;
故答案为:蒸发浓缩、降温结晶;蒸发皿、玻璃棒、酒精灯、铁架台;
(4)①样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(CaCl2)=$\frac{1}{2}$n(AgCl)=$\frac{1}{2}$×0.05000mol•L-1×0.02039L×10=0.0050975mol,所以m(CaCl2)=0.0050975mol×111g/mol=0.5658g,则有:$\frac{0.5658g}{0.5800g}$×100%=97.6%,
故答案为:97.6%.
点评 本题考查混合物中含量的测定,涉及实验的基本操作、实验仪器的选择、实验误差分析、混合物分离及含量测定的计算等,题目综合性较强,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| B. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | SO3与CO32-互为等电子体,SO3是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
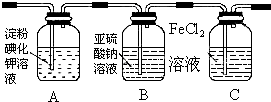
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
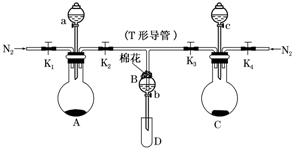 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp2 | 正四面体形 | 正四面体形 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 常温下,pH=5的盐酸稀释1000倍后,溶液的pH=8 | |
| D. | 水的离子积随温度升高而增大,说明水的电离是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | At是有色固体 | ||
| C. | At易溶于有机溶剂 | D. | AgAt不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属原子间不可能形成离子键 | B. | 只有不同的原子间才能形成共价键 | ||
| C. | 共价化合物中不可能含离子键 | D. | 离子化合物中可能含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com