
��15�֣�̫���ܵ�������ù��ЧӦʵ�������仯��һ������װ�ã�Ŀǰ����õ�����Ͷྦྷ����Ϊ�������ϡ��ߴ��ȵľ�����ͨ�����·�Ӧ��ã�
��Ӧ�٣��ϳ�¯����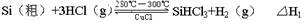
��Ӧ�ڣ���ԭ¯����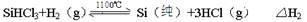
�й����ʵķе����±���ʾ��
| ���� | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| �е� | 12��1 | 73��5 | 57��0 | 129��4 | 180�������� | 31��2 |
��1��̫����ת��Ϊ���ܣ�1�֣� ����1�֣� ��2��Kp= PH2��PSiHCl3/P3HCl����2�֣�
(3) ��>��2�֣�
��0��01mol��L-1��min-1 ��2�֣�
����1100��ʱ��������ȶ�SiHCl3ʣ����Ӱ�����ԣ�����775�� ʱ��������ȶ�SiHCl3��ʣ����Ӱ�첻���ԣ�2�֣�
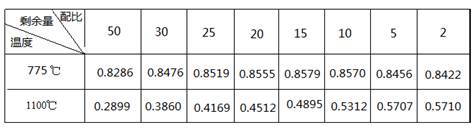
��4�� �� > ��2�֣� ����ͼ��3�֣�
���������������1��̫���ܵ�ص�����ת����ʽΪ̫����ת��Ϊ���ܣ����ݱ������ݿ�֪SiHCl3�ķе�ϵͣ��ɲ�������ķ�ʽ�ᴿ����2���������ʵ���Ũ��ƽ�ⳣ������ʽǨ�Ƶõ�ѹǿƽ�ⳣ����ѹǿƽ�ⳣ��Ϊ�����������ѹ��ϵ�����ݵij˻��뷴Ӧ�������ѹϵ�����ݳ˻��ı�ֵ����Ӧ�ٵ�KP��PH2��PSiHCl3/P3HCl����3���ٷ����������֪����SiHCl3�����������ͬʱ��775��ʱ��SiHCl3ʣ��������1100��ʱ��SiHCl3ʣ��������֪�¶����ߣ�ƽ�����淴Ӧ�����ƶ�������Ӧ�������ȣ�����H2��0���ڷ�Ӧ��4minʱ���HCl��Ũ��Ϊ0.12mol?L-1����v��HCl��=0.03mol��L-1��min-1�����û�ѧ������֮�ȵ��ڷ�Ӧ����֮�ȣ�v��SiHCl3��=1/3��0.03mol��L-1��min-1=0.01mol��L-1��min-1���۷����������֪�����������ͬʱ����1100��ʱ��������ȶ�SiHCl3ʣ����Ӱ�����ԣ�����775��ʱ��������ȶ�SiHCl3��ʣ����Ӱ�첻���ԣ���4���ٱȽϷ�Ӧ��ǰ�����������С������ѹǿ��SiHCl3ʣ�������۲�ͼ���֪P1���������ϲ࣬��P1ѹǿ��SiHCl3ʣ������P1��P2���ڷ�Ӧ�ڣ�����Ӧ���������������ѹǿ������SiHCl3ʣ������������Ӧ�������ȣ��¶�������SiHCl3ʣ�������ݴ˻���ͼ����𰸡�
���㣺���黯ѧ��Ӧ���ʺͻ�ѧƽ�⡣


 ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ʵ������ͭ��ϡ������ȡNOʱ��Ϊ�ӿ췴Ӧ���ʿɲ�ȡ�Ĵ�ʩ��
| A������ͭ������ | B������ѹǿ |
| C�������������� | D�����������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(6��) ��һ���¶���,��4mol SO2��2molO2����4L���ܱ������У���һ�������·�Ӧ��10����ʱ�ﵽƽ�⣺ 2SO2 + O2 2SO3 ���ƽ��ʱ����������ʵ���Ϊ5mol����
2SO3 ���ƽ��ʱ����������ʵ���Ϊ5mol����
��1��10����ʱO2�ķ�Ӧ����Ϊ mol/(L��min)��2��ƽ��ʱSO2��ת����
(3) ƽ�ⳣ��KΪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��10�֣���һ������SO2�ͺ�0.7mol�����Ŀ���(����CO2)����0.5 L�ܱ������ڣ�550��ʱ���ڴ��������·�����Ӧ��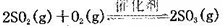 ������Ӧ���ȣ������n��O2����ʱ��ı仯���±�
������Ӧ���ȣ������n��O2����ʱ��ı仯���±�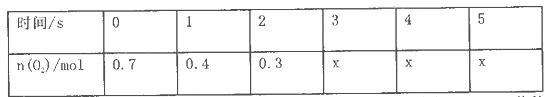
��Ӧ�ﵽ5s�������еĻ������ͨ������NaOH��Һ���������������22. 4L�������Ϊ��״���µ���������ٽ�ʣ������ͨ������ûʳ����ļ�����Һ����O2�����������ּ�����5.6L�������Ϊ��״���µ��������
��ش��������⣺
��1����O2��ʾ��0-ls�ڸ÷�Ӧ��ƽ����Ӧ����Ϊ__________________��
��2��O2��ƽ��Ũ��c (O2)=____________________________��
��3�� 4sʱ��SO2����������____________������ڡ�����С�ڡ����ڡ���O2���������ʡ�
��4����÷�Ӧ�ﵽƽ��ʱSO2��ת������________���ðٷ�����ʾ����
��5������ƽ���̨������SO3��5%ͨ�������BaCl2��Һ�����ɳ���_______�ˣ�����������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ܱ���Ϊδ�������������Դ����ѧ��Ԥ�⡰���ܡ�����21���������������Դ��Ŀǰ�ֽ�ˮ�������Ĺ�ҵ�Ʒ�֮һ�ǡ���ѭ��������Ҫ�漰���з�Ӧ��
�� SO2+2H2O+I2�� H2SO4+2HI ������������ 2HI H2+I2
H2+I2
�� 2H2SO4�� 2SO2��+O2��+2H2O
��1������������Ӧ�������ж���ȷ���� ��
a����Ӧ�����ڳ����½��� b����ӦI��SO2��ԭ�Ա�HIǿ
c��ѭ���������貹��H2O d��ѭ�������в���1molO2��ͬʱ����1molH2
��2��һ���¶��£���2L�ܱ������м���1mol HI(g)��������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0��2min�ڵ�ƽ����Ӧ����v(HI)= �� �����¶��£���Ӧ2HI(g) H2(g)+I2(g)��ƽ�ⳣ��K= ����ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������ ��ԭ����2����
H2(g)+I2(g)��ƽ�ⳣ��K= ����ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������ ��ԭ����2����
a��ƽ�ⳣ�� b��HI��ƽ��Ũ��
c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
��3��SO2��һ�������¿ɱ���������SO3���䷴ӦΪ��2SO2 (g) + O2(g)  2SO3(g) ��H<0��ij���е�λ����ԭ���ԭ������SO2��O2���Ʊ����ᣬװ����ͼ���缫Ϊ��IJ��ϣ����������壬ͬʱҲ��ʹ������������Һ��ֽӴ���
2SO3(g) ��H<0��ij���е�λ����ԭ���ԭ������SO2��O2���Ʊ����ᣬװ����ͼ���缫Ϊ��IJ��ϣ����������壬ͬʱҲ��ʹ������������Һ��ֽӴ��� 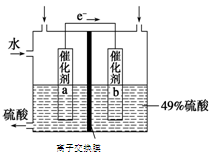
��a�缫�ĵ缫��ӦʽΪ ��
�����õ�������Ũ����Ϊ49%���������ϲμӷ�Ӧ��SO2������H2O��������Ϊ ��
��4��ʵ�������������ð�ˮ����SO2�������������Ρ���ȡa�˸���Σ��������е�SO2ȫ����Ӧ������Ӧ����10 mol/L��������Һ�������ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��9�֣�����������������OH-�����·���ˮ�ⷴӦ��O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| ��/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��8�֣���1��ij�¶�ʱ����2 L�ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ��____________________________
��2�� ��Z��ʾ��0��2min�ڸ÷�Ӧ��ƽ����Ӧ����Ϊ
____________________
��3�� ijʱ��t��t��5min�����Y��Z���ߵ����ʵ���֮��Ϊ
3:1����X��ת����Ϊ_________
��4�� �������£���˵����Ӧ�Ѵﵽƽ��״̬����
a��������z���ʵ���Ũ��Ϊ0.25mol/L
b������Ӧ���淴Ӧ�����ʶ�Ϊ0
c��������X��Y��Z���ʵ���֮��Ϊ1��3��2
d��������X����������������
e. ��λʱ��������3a mol X��ͬʱ����2a mol Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��15�֣���֪��ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ������ش��������⣺
��1�����淴ӦFeO��s����CO��g�� Fe��s����CO2��g����������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
Fe��s����CO2��g����������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
| T��K�� | 938 | 1100 |
| K | 0.68 | 0.40 |
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
mA(��) + nB(��) pC(��) + qD(��)�� C %��ʱ�� t����ͼ��ϵ
pC(��) + qD(��)�� C %��ʱ�� t����ͼ��ϵ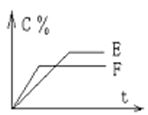
(1)��E��F��ʾ�����¶ȣ��� E____F���������������������������Ӧ____ �ȡ�
(2)��E��F��ʾ����ѹǿ���� m + n_____p + q��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com