
| A. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | PH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 新鲜的空气中:SO2、NO、N2、NH3 | |
| D. | 所有氯气的集气瓶中:H2S、H2、HCl |
分析 A.离子之间不发生任何反应;
B.发生氧化还原反应;
C.NO易与氧气反应;
D.氯气具有强氧化性,硫化氢具有强还原性.
解答 解:A.Fe3+与其它离子之间不发生任何反应,可大量共存,故A正确;
B.PH=1的溶液呈酸性,酸性条件下,Fe2+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.NO易与氧气反应,在空气中稳定存在,故C错误;
D.氯气具有强氧化性,硫化氢具有强还原性,二者发生氧化还原反应,不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高频考点和常见题型,侧重元素化合物知识的综合理解和运用的考查,明确习题中的信息及离子之间的反应是解答本题的关键,注意发生的氧化还原反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取溴水中的溴,将四氯化碳和溴水混合后,振荡并打开分液漏斗瓶塞,使漏斗内气体放出 | |
| B. | 在蔗糖中加入浓硫酸时,蔗糖变黑,证明浓硫酸具有脱水性 | |
| C. | 向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀,可推测SO2与可溶性钡盐均能反应产生白色沉淀 | |
| D. | 若要检验铜和浓硫酸反应后产物硫酸铜,可向反应后的试管中加入少量水,观察溶液是否变蓝,若变蓝则证明有硫酸铜生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3CO0-) | |
| B. | 加水稀释时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈酸性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
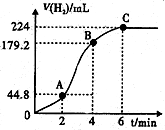
| 实验现象 | 原因 |
| 溶液从初的紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊试液变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此干燥剂为混合物 | |
| B. | 小纸袋中的物质可长期持续地做干燥剂 | |
| C. | 其中钙元素的存在形态为游离态 | |
| D. | 此干燥剂不能和盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③⑥ | C. | ①⑥ | D. | ①④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com