
8.765 g
解析:2NO2——R2+——2OH-,3NO2——R3+——3OH-,NO——R3+——3OH-,2NO——3R2+——6OH-。从而得出下列关系:NO2——OH-,NO——3OH-。这个关系我们也可以从电荷守恒的角度加以理解。因为HNO3中的+5价N转化为NO2中的+4价N,得到1个电子,相当于生成1个带一个单位负电荷的离子,此离子的带电荷等同于OH-;同样,HNO3中的+5价N转化为NO中的+2价N,得到3个电子,相当于生成3个带一个单位负电荷的的离子,此离子的带电荷等同于OH-。这样,就得出了m(沉淀)=m(金属离子)+m(OH-)=m(金属)+n(NO2)×M(OH-)+3n(NO)×M(OH-)=8.765 g。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.
不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:填空题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体。
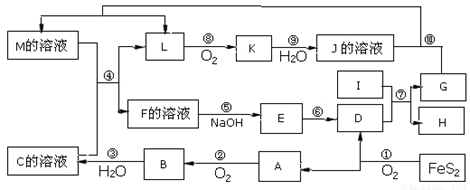
请填写下列空白:
(1)组成单质I的元素在周期表中的位置为 。
(2)欲检验F溶液中是否含有少量M,可选择的试剂为 (填化学式)。
(3)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是__________________________。
(6)镁与I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、I单质在一定温度下熔炼获得。
①熔炼制备镁I合金时通入氩气的目的是 。
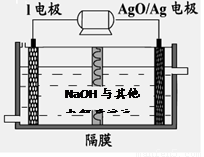
②I电池性能优越,I-Ag2O 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com