
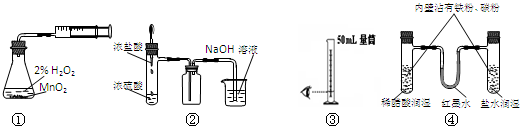
| A.装置①测定化学反应速率 | B.装置②制取并吸收HCl |
| C.装置③量取8.5mL的稀硫酸 | D.装置④模拟铁的腐蚀 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
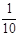 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.10mL,末读数如右图所示。
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.10mL,末读数如右图所示。

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。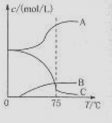
 NaC1O3+3H2↑
NaC1O3+3H2↑ HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
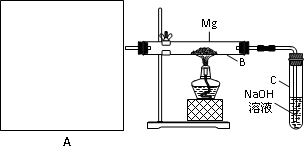
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10 | B.50 | C.5×103 | D.104 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
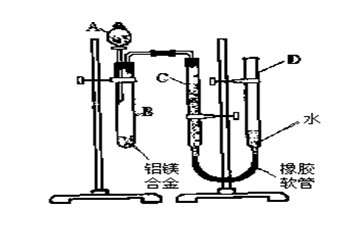
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
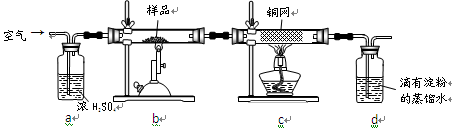
 NaOH溶液吸收过量的CO2气体,至CO2
NaOH溶液吸收过量的CO2气体,至CO2 气体不再溶解;
气体不再溶解;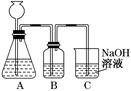
 的试剂是_____
的试剂是_____  _,作用是_____________________________________________
_,作用是_____________________________________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com