
科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
(1)稀硫酸和铁粉
(2)杀菌剂(强氧化剂)和吸附剂(净水剂)
(3)Zn+2OH--2e-=Zn(OH)2 变小
(4)FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-218 kJ/mol
【解析】(1)FeSO4是强酸弱碱盐,易发生水解使溶液呈酸性,配制溶液时,需加入稀硫酸抑制Fe2+水解,FeSO4具有较强的还原性,还需加入铁粉,防止Fe2+被氧化。
(2)高铁酸钾中铁为+6价,具有很强的氧化性,可用于杀菌,高铁酸钾的还原产物是Fe3+,易水解生成氢氧化铁胶体,具有较强的吸附杂质的能力,可用于净水。
(3)该电池放电时,Zn失电子,为电池的负极,结合产物Zn(OH)2,可写出放电时的负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-。充电时,充电电池的阳极与电源的正极相连,阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O,pH变小。
(4)根据反应FeO(s)+CO(g)=Fe(s)+CO2(g)与高炉炼铁的反应可知:3×①-②-2×③得到6FeO(s)+6CO(g)=6Fe(s)+6CO2(g) ΔH=-1 308 kJ/mol,简化成FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-218 kJ/mol。


科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
某酸性溶液可能含有Br-、SO42-、H2SO3、NH4+等,分别对该溶液进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练1 化学基本概念练习卷(解析版) 题型:选择题
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25 mL 0.1 mol/L Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O32-将转化为( )
A.SO42- B.SO32- C.S D.S2-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务。下列举措不符合这一要求的是( )
A.为推广氢能的使用,工业上可采用电解水法制取大量氢气
B.将石油裂化、裂解,综合利用石油资源
C.有节制地开采煤、石油、天然气等矿物资源
D.将某些废旧塑料熔化后再成型
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列叙述错误的是( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:填空题
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。

A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
《京都议定书》针对六种温室气体进行削减,包括二氧化碳(CO2)、甲烷(CH4)、氧化亚氮N2O)、氢氟碳化物(HFCs)、全氟碳化物(PFCs)及六氟化硫(SF6)。科学研究发现,同条件下等体积的甲烷产生的温室效应远强于二氧化碳的。下列说法正确的是( )
A.在相等质量下,二氧化碳产生温室效应比甲烷的强
B.天然气是清洁能源,燃烧天然气不对环境产生任何影响
C.二氧化碳对全球升温的贡献百分比最大,是因为二氧化碳含量较多
D.氟利昂可作制冷剂,大量向空气中排放氟利昂,会使气温降低
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石。已知该尖晶
石中混有Fe2O3,取一定量样品5.4 g,恰好与一定浓度100 mL盐酸反应,盐酸浓度可能是( )
A.4.9 mol·l-1 B.4.3 mol·L-1
C.3.1 mol·L-1 D.2.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中
错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于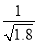 ×10-11 mol·L-1
×10-11 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com