
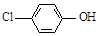
 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。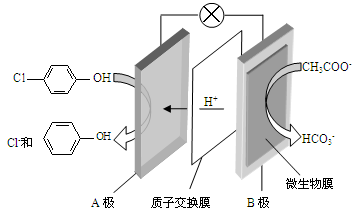
 2HCO3- + 2NH3
2HCO3- + 2NH3 -OH + 2e- + H+ ="=="
-OH + 2e- + H+ ="=="  -OH + Cl-
-OH + Cl- 2HCO3- + 2NH3
2HCO3- + 2NH3 -OH + 2e- + H+ ="=="
-OH + 2e- + H+ ="=="  -OH + Cl-
-OH + Cl-

 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:不详 题型:单选题
 KIO3+3H2↑,下列说法正确的是( )
KIO3+3H2↑,下列说法正确的是( )| A.电解时,石墨做阴极,铁做阳极 |
| B.电解时,在阳极产生氢气 |
| C.电解后得KIO3产品的步骤有:过滤→浓缩→结晶→灼烧 |
| D.电解中,每转移0.6 mol电子,理论可得0.1 mol无水KIO3晶体 |
查看答案和解析>>
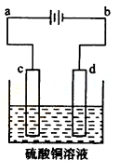
科目:高中化学 来源:不详 题型:单选题
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 | B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | D.在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
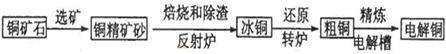
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
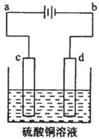
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+物质的量浓度 | B.C棒的质量 |
| C.Fe棒的质量 | D.Cl-物质的量浓度 |
查看答案和解析>>
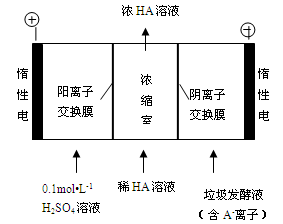
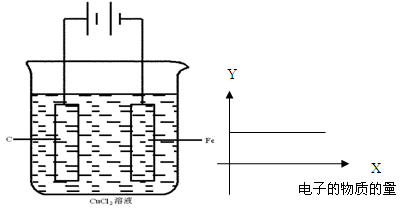
科目:高中化学 来源:不详 题型:问答题
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: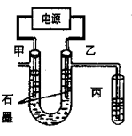
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a 为电源的正极 |
| B.通电一段时间后,石墨电极附近溶液先变红 |
| C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑ |
D.电解饱和食盐水的总反应是: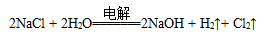 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a为直流电源的负极 |
| B.阴极的电极反应式为:2HSO3-+2H++e-=S2O42-+2H2O |
| C.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
| D.电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com