
【题目】常温下,下列各溶液中微粒的物质的量浓度关系正确的是
①c(NH![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
②向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③1.0mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
④某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
⑤将pH=6的H2SO4稀释1000倍后,c(H+)=200c(SO![]() )
)
A.①②B.③⑤C.④⑤D.②④
【答案】B
【解析】
①(NH4)2SO4溶液中铵根离子水解,NH4HSO4溶液中电离出的氢离子抑制铵根离子水解,NH4Cl溶液中铵根离子水解,c(NH4+)相等时,溶质浓度c(NH4Cl)>c(NH4HSO4)]>c((NH4)2SO4),故①错误;
②向醋酸钠溶液中加入适量醋酸,溶液中醋酸电离程度大于醋酸根离子水解程度,得到的酸性混合溶液存在电荷守恒:c(Na+)+c(H+)=c(CH3COO)+c(OH),得到的酸性混合溶液,c(H+)>c(OH),c(Na+)<c(CH3COO),c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故②错误;
③1.0mol/LNa2CO3溶液中存在质子守恒:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故③正确;
④某二元弱酸的酸式盐NaHA溶液中一定存在电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故④错误;
⑤将pH=6的H2SO4氢离子的浓度为c(H+)=10-6,c(SO![]() )=5×10-7,稀释1000倍后,c(H+)≈10-7,c(SO
)=5×10-7,稀释1000倍后,c(H+)≈10-7,c(SO![]() )=5×10-10,c(H+)=200c(SO
)=5×10-10,c(H+)=200c(SO![]() ),故⑤正确;
),故⑤正确;
正确的是③⑤,答案选B。


科目:高中化学 来源: 题型:
【题目】乙酰水杨酸,俗称阿司匹林(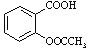 ),是常用的解热镇痛药。实验室合成流程如下:
),是常用的解热镇痛药。实验室合成流程如下:
![]()
查阅资料:
阿司匹林:受热易分解,溶于乙醇、难溶于水
水杨酸(邻羟基苯甲酸):溶于乙醇、微溶于水
醋酸酐[(CH3CO)2O]:无色透明液体,溶于水形成乙酸
请根据以上信息回答下列问题:
(1)①合成阿司匹林时,下列几种加热方式最合适的_____________。
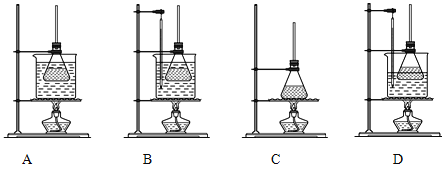
②合成阿司匹林使用的锥形瓶必须干燥的原因是______________。
③如右图所示装置,通过抽滤可使粗产品与母液分离。下列说法不正确的是____________。
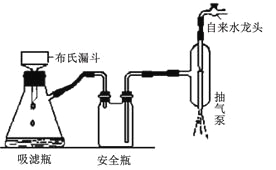
A.抽滤能加快过滤速率,得到相对干燥的沉淀,但颗粒太小的沉淀不能用此装置
B.当溶液具有强酸性、强氧化性时,可用玻璃砂漏斗代替布氏漏斗
C.抽滤时,当吸滤瓶内液面快到支管口时,先拔掉吸滤瓶上橡皮管,再从吸滤瓶支管口倒出溶液
D.洗涤晶体时,先关闭水龙头,用洗涤剂缓慢淋洗,再打开水龙头抽滤
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤。加入饱和NaHCO3溶液的目的是(用化学反应方程式表示)__________________。
(3)另一种改进的提纯方法,称为重结晶提纯法。
![]()
①最后步骤中洗涤剂最好选择_______________。
A.15%的乙醇溶液 B.NaOH溶液 C.冷水 D.滤液
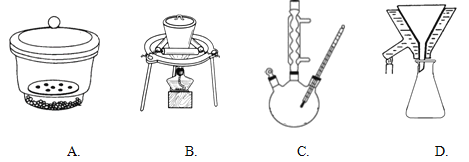
②下列装置在上述流程中肯定用不到的是_______________。
③重结晶时为了获得较大颗粒的晶体产品,查阅资料得到如下信息:
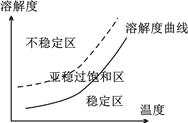
1.不稳定区出现大量微小晶核,产生较多颗粒的小晶体
2.亚稳过饱和区,加入晶种,晶体生长
3.稳定区晶体不可能生长
由信息和已有的知识分析,从温度较高浓溶液中获得较大晶体颗粒的操作为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A分子式为CxHyOz,15gA在足量氧气中完全燃烧生成22gCO2和9gH2O。
⑴求该有机物的最简式_________;
⑵若A是某种无色具有刺激性气味的气体,且有还原性,则结构简式是_______;
⑶若A的相对分子质量为180,l molA与足量的Na反应生成2.5mol氢气,该物质还能反生银镜反应,人体血液中A含量过高会得糖尿病,则其结构简式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池,如图所示,该电池可将可乐(pH=2.5)中的葡萄糖作为燃料产生能量。下列说法正确的是( )

A.a极为正极
B.随着反应的进行,负极区的pH不断增大
C.消耗0.1mol葡萄糖,电路中转移0.2mol电子
D.b极的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(t℃)时,水的Kw=1×10-13,则该温度(填“大于”、“小于”或“等于”)__25℃,其理由是__。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,若所得混合液为中性,则a:b=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是CO2生产甲醇的能量变化示意图。下列说法正确的是( )

A.E2-E1是该反应的反应热
B.E3-E1是该反应的反应热
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有利于控制温室效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com