
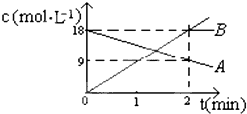
 反应:A═2B中,A、B的浓度变化如图所示.则2min以内的平均反应的速率为( )
反应:A═2B中,A、B的浓度变化如图所示.则2min以内的平均反应的速率为( )| A、vA=9 mol/(L?min) |
| B、vA=4.5 mol?L?min |
| C、vB=18 mol/(L?min) |
| D、vB=9mol/(L?min) |
科目:高中化学 来源: 题型:
| A、盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O |
| B、工业用FeCl3溶液腐蚀铜线路板:Fe3++Cu=Fe2++Cu2+ |
| C、酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
| D、食醋浸泡有水垢的暖壶或水壶,清除其中的水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+ |
| B、Al3+ |
| C、Fe2+ |
| D、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何气体所含分子数都相等,体积也都约为22.4L |
| B、在标准状况下,18 gH2O所占的体积约是22.4L |
| C、以g?mol-1为单位时,在数值上摩尔质量与相对分子质量或相对原子质量相等 |
| D、同质量的O2和O3所含的氧原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②>①>④>③ |
| B、③>④>①>② |
| C、③>④>②>① |
| D、④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| B、将SO2分别通人品红和氯水溶液,溶液都会褪色,而且再经加热都能恢复原色 |
| C、浓H2SO4,具有强氧化性,不能与Cu发生剧烈反应 |
| D、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com