
【题目】下列反应属于取代反应的是( )
A.CH2=CH2+Br2→CH2BrCH2Br
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.C3H8 + 5O2 ![]() 3CO2 + 4H2O
3CO2 + 4H2O
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A. c1∶c2=3∶1B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率相等D. c1的取值范围为0.04 mol·L-1 < c1 < 0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛是制取航天航空工业钛合金的重要原料.用钛铁矿![]() 主要成分是钛酸亚铁
主要成分是钛酸亚铁![]() ,含少量
,含少量![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 作原料生产金属钛和绿矾
作原料生产金属钛和绿矾![]() 等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以
等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以![]() 无色
无色![]() 、
、![]() 紫色
紫色![]() 形式存在.
形式存在.
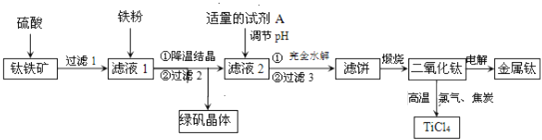
请回答下列问题:
![]() 硫酸与
硫酸与![]() 反应生成
反应生成![]() 的化学方程式是______.
的化学方程式是______.
![]() 滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
已知:氧化性:![]() 则加入铁粉的作用是______.
则加入铁粉的作用是______.
![]() 滤液2中加入适量的试剂A,可选用______
滤液2中加入适量的试剂A,可选用______![]() 填编号
填编号![]() .
.
![]() 稀
稀![]() 通入
通入![]() 鼓入空气
鼓入空气
![]() 已知
已知![]() ,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
![]() ,
,
![]() ,
,
![]()
反应![]() ______.
______.
![]() 用石墨作阳极、钛网作阴极、熔融
用石墨作阳极、钛网作阴极、熔融![]() 作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
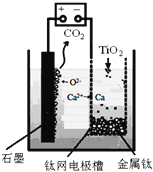
![]() 假如
假如![]() 中的铁元素占矿物中铁元素总量的
中的铁元素占矿物中铁元素总量的![]() ;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为
;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为![]() ,Ti元素的转化率为
,Ti元素的转化率为![]() ,其他损失忽略不计.按上述流程,得到
,其他损失忽略不计.按上述流程,得到![]() ______
______![]() 用数字和字母表示
用数字和字母表示![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染。某课题组利用煤矸石制备聚合氯化铝流程如下:
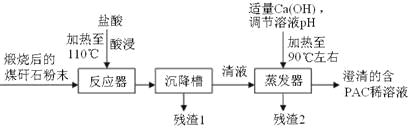
已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
(1)酸浸的目的是___________________________;实验需要的500mL3.0 mol·L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有______________________。
(2)若m=n=2,则生成PAC的化学方程式是_____________________。
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是_______、_________、_________。
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL。已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平)。判断滴定终点的依据是_______________________;残渣2中铁元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
①![]()
![]() 和
和![]() 的混合气体中含有的原子个数为
的混合气体中含有的原子个数为![]()
②常温下,4g ![]() 含有
含有![]() 个
个![]() 共价键
共价键
③![]() 质量分数为
质量分数为![]() 的
的![]() ,加水至100mL,
,加水至100mL,![]() 的质量分数为
的质量分数为![]()
④标准状况下,![]() 四氯化碳含有的分子数为
四氯化碳含有的分子数为![]()
⑤![]() 时,
时,![]() 的
的![]() NaClO溶液中水电离出的
NaClO溶液中水电离出的![]() 的数目为
的数目为![]()
⑥![]() 溶液中含有
溶液中含有![]() 个
个![]()
⑦![]()
![]() 与水完全反应时转移电子数为
与水完全反应时转移电子数为![]()
A.③⑥⑦B.①②④C.①②⑤D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,lmol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断,下列说法不正确的是

A.432kJ·mol-1>E(H—Br)>298KJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)→2H(g)△H=+436kJ·mol-1
D.H2(g)+F2(g)=2HF(g)△H=-25kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2被称为“空中死神”,其对环境的危害常表现为_______________。为了减少危害,人们进行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。
(1)工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于_______氧化物的性质。
(2)近年来,有人提出了一种利用电解饱和氯化钠溶液,循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:

①此种方法中,可以循环利用的物质是_____________________________。
②写出反应Ⅰ的离子方程式:_____________________________________。
(3)SO2通过下列工艺流程可制备化工原料H2SO4和清洁能源H2

下列说法中正确的是____________ 。
A. 设备A中的溴水褪色,体现了SO2的漂白性
B. 该生产工艺的优点:Br2可以循环利用,并获得清洁能源H2
C. 该工艺流程的总反应方程式为:SO2+2H2O=H2SO4+H2
D. 设备B中物质分离操作为过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(l) △H3
④H2O(l)=H2O(g) △H4=+44.0kJ/mol
(1)已知反应CO2(g)+H2(g)=CO(g)+H2O(g)△H,中相关的化学键键能数据如下:

由此计算△H=______,则△H3=_______。
(2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是___。
(3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示,图中A点和B点的平衡常数比较:KA___KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:a.___。b.___。
(4)常温常压下,向一个2.00L的密闭恒容容器中加入等量2.00mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)________、_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com