
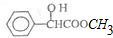
| A. | 分子式为C9H10O3 | |
| B. | 可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol该物质最多可与4mol H2发生加成反应 | |
| D. | 其苯环上的二氯代物共有六种结构 |
分析 该有机物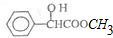 中含有1个酯基、1个羟基和1个苯环,根据含有C原子及不饱和度可确定其分子式,根据含有官能团结构可判断具有化学性质,据此进行解答.
中含有1个酯基、1个羟基和1个苯环,根据含有C原子及不饱和度可确定其分子式,根据含有官能团结构可判断具有化学性质,据此进行解答.
解答 解:A.该有机物分子中含有个羧基、1个羟基和1个苯环,其不饱和度为4+1=5,含有9个C原子,则其分子中含有H原子数为:9×2+2-5×2=10,该有机物的分子式为:C9H10O3,故A错误;
B.含有羟基,能够发生酯化反应(取代反应)和氧化反应,含有苯环,能够发生加成反应,苯环能够与氢气发生还原反应,故B正确;
C.酯基不能发生加成反应,1mol该有机物含有1mol苯环,能够与3mol氢气发生加成反应,故C错误;
D.其苯环的上的碳原子为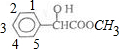 ,将1个Cl原子固定在1号C,则另一个Cl原子可以在2、3、4、5号C,产生的二氯代物有12、13、14、15,总共4种;将1个Cl原子固定在2号C,另一个氯原子可以在3、4号C,具有23、24两种结构;若氯原子在3号C,34、25的二氯代物与13、23重复,所以满足条件的结构总共有4+2=6种,故D正确;
,将1个Cl原子固定在1号C,则另一个Cl原子可以在2、3、4、5号C,产生的二氯代物有12、13、14、15,总共4种;将1个Cl原子固定在2号C,另一个氯原子可以在3、4号C,具有23、24两种结构;若氯原子在3号C,34、25的二氯代物与13、23重复,所以满足条件的结构总共有4+2=6种,故D正确;
故选C.
点评 本题考查了有机物结构与性质,题目难度中等,明确常见有机物官能团结构及对应的化学性质为解答关键,注意掌握根据不饱和度确定有机物分子中H原子数目的方法,试题培养了学生的分析能力及灵活应用能力.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
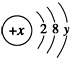 ( y≠0 ).请回答:
( y≠0 ).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
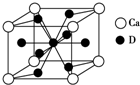 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步 骤 | 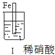 | 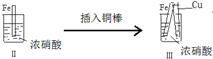 | |
| 现 象 | 铁表面产生大量无色气泡,液面上方变为红棕色 | 铁表面产生少量红棕色气泡后,迅速停止 | 铁、铜接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2→2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6g石墨中的共价键数目 | |
| B. | 常温常压下,17g ND3中所含分子数目 | |
| C. | 0.1mol羟基(-OH)中所含电子数目 | |
| D. | 向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com