
| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
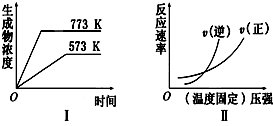
分析 由左边的图象可知,温度越高生成物的浓度越大,说明升高温度,平衡向正反应移动,故正反应为吸热反应;由右边图象可知,相交点左边未达平衡,相交点为平衡点,相交点右边压强增大,平衡被破坏,V逆>V正,平衡向逆反应移动,说明正反应为气体物质的量增大的反应;综合上述分析可知,可逆反应正反应为吸热反应且正反应为气体物质的量增大的反应,据此结合选项解答.
解答 解:由左边的图象可知,温度越高生成物的浓度越大,说明升高温度,平衡向正反应移动,故正反应为吸热反应;
由右边图象可知,相交点左边未达平衡,相交点为平衡点,相交点右边压强增大,平衡被破坏,V逆>V正,平衡向逆反应移动,说明正反应为气体物质的量增大的反应;
综合上述分析可知,可逆反应正反应为吸热反应且正反应为气体物质的量增大的反应,
A.2SO3(g)?2SO2(g)+O2(g)△H>0,为吸热反应,正反应是气体物质的量增大的反应,故A符合;
B.N2(g)+3H2(g)?2NH3(g)△H<0,为放热反应,正反应是气体物质的量减小的反应,故B不符合;
C.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,正反应是气体物质的量增大的反应,但为放热反应,故C不符合;
D.H2(g)+CO(g)?C(s)+H2O(g)△H>0,为吸热反应,但正反应是气体物质的量减小的反应,故D不符合;
故选A.
点评 本题考查化学平衡移动图象、外界条件对化学平衡的影响等,难度不大,掌握外界条件对化学平衡的影响即可解答,注意根据图象判断可逆反应的特征.


科目:高中化学 来源: 题型:多选题
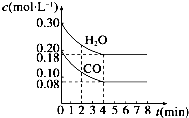 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H<0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30mol CO、0.10mol H2O、0.20mol CO2和20mol H2,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯的结构简式: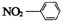 | B. | CO2分子比例模型: | ||
| C. | HClO的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①=④>③=② | D. | ④=①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | B. | 所得的分散系中的分散质为Fe2O3 | ||
| C. | 给分散系通电时阳极周围黑色不变 | D. | 该分散系能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L醋酸 | B. | 0.5L0.1mol/L氯化钠溶液 | ||
| C. | 0.1L0.1mol/L硫酸钠溶液 | D. | 2L0.1mol/L磷酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com