
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物,其合成路线如下:
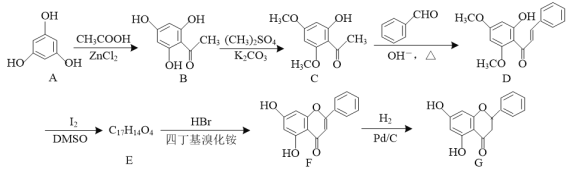
(1)G中的含氧官能团名称为羟基、____、____。
(2)A→B的反应类型为____。
(3)E的结构简式为____。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:____。
Ⅰ.既能发生银镜反应,也能发生水解反应;
Ⅱ.能与FeCl3发生显色反应,核磁共振氢谱图中有4个峰。
(5)已知:![]() (R’表示烃基或氢原子)。请写出以
(R’表示烃基或氢原子)。请写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)。_______
的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水中c(H+)=2×10﹣7 molL﹣1,则此时温度____填(“高于”、“低于”或“等于”)25°C,此温度下水的离子积为____。若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 molL﹣1,则此时c(OH﹣)=____。由水电离产生的c(H+)为____
(2)25℃,有pH=12的氢氧化钠溶液100mL,要使它的pH降为11.应加蒸馏水的体积为_____mL;若加pH=10的氢氧化钠溶液,应加_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:

已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
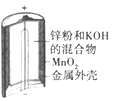
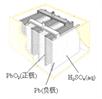
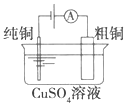
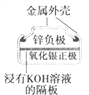
(a)碱性锌锰电池 (b)铅-硫酸蓄电池 (c)电解精炼铜 (d)银锌纽扣电池
A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用甲酸钠(HCOONa)制备Na2S2O4并测定产品的纯度,实验装置(夹持、加热仪器略)如图

将反应液分离提纯得到Na2S2O4产品,取产品mg溶于水,并定容为100mL,取25.00mL加入锥形瓶中,加入NaOH溶液及指示剂,用cmol·mol-1的K3[Fe(CN)6]标准溶液进行滴定{4K3[Fe(CN)6]+2Na2S2O4+8NaOH=3K4[Fe(CN)6]+4Na2SO3+Na4[Fe(CN)6]+4H2O},滴定至终点时,消耗标准液VmL。则产品的纯度为________(写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
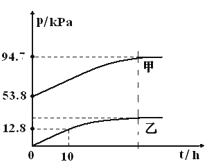
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 恒温恒压下,在容积可变的器皿中,反应2NO2 (g)![]() N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.减小 B.增大 C.不变 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性燃料电池酒精检测仪原理如图所示。下列说法中正确的是( )

A.正极上发生的反应是:O2+4e-+2H2O===4OH-
B.负极上发生的反应是:CH3CH2OH-4e-+H2O ===CH3COOH+4H+
C.检测时,电解质溶液中的H+向负极移动
D.若有0.4 mol电子转移,则消耗标准状况下4.48 LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com