
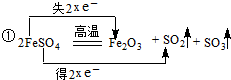 ;
;分析 (1)①FeSO4中,S为+6价,化合价变化为+6→+4,铁的化合价由+2→+3,电子转移为2e-;
②FeSO4分解产物为:SO3和SO2,根据SO3与氯化钡溶液反应生成硫酸钡沉淀,而SO2与氯化钡溶液不反应分析;
(2)①溶液由黄色变为浅绿色,说明Fe3+与SO2气体反应生成Fe2+和SO42-,据此书写离子方程式;
②由①的反应可知,溶液中肯定有Fe2+,则检验H2SO3就不能根据其还原性,据此分析;
(3)根据三价铁离子、铜离子的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;若有固体剩余,若固体只有铜,则反应后的溶液中一定无三价铁离子存在,一定存在亚铁离子,可能含有铜离子;若有铁剩余,一定还有铜生成,则反应后的溶液中一定只有亚铁离子;若无固体剩余,则溶液中一定有Fe2+
和Cu2+,可能有Fe3+.据此进行判断.
解答 解:(1)FeSO4高温分解,反应方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,FeSO4中,S为+6价,化合价变化为+6→+4,铁的化合价由+2→+3,电子转移的方向和数目为: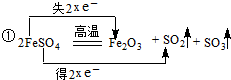 ;故答案为:
;故答案为: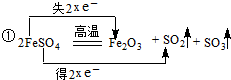 ;
;
②FeSO4高温分解气体为SO2和SO3,SO3与氯化钡溶液反应生成硫酸钡沉淀,而SO2与氯化钡溶液不反应,所以将所得气体混合物通入氯化钡溶液,新得到的钡盐是BaSO4;故答案为:BaSO4;
(2)①溶液由黄色变为浅绿色,说明Fe3+与SO2气体反应生成Fe2+和SO42-,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②由①的反应可知,溶液中肯定有Fe2+,则检验H2SO3就不能选择强氧化剂KMnO4溶液,又H2SO3为剩余的SO2与水反应生成,所以用品红溶液检验,故选:D;
(3)A.若无固体剩余,则肯定发生反应2FeCl3+Fe=3FeCl2,所以溶液中一定有Fe2+,可能有Fe3+,故A错误;
B.若有固体剩余,若固体只有铜,则反应后的溶液中一定无三价铁离子存在,一定存在亚铁离子,可能含有铜离子;若有铁剩余,一定还有铜生成,则反应后的溶液中一定只有亚铁离子,所以则溶液中一定有Fe2+,故B正确;
C.若溶液中有Cu2+,则可能析出一部分铜,故C错误;
D.若溶液中有Fe2+,铁较少时,铜离子没有反应,则不一定有Cu析出,故D错误;
E.若溶液中没有Cu2+,说明铁将铜置换出来了,所以Fe3+更被铁还原了,故E正确;
故选BE.
点评 本题考查了物质性质实验方案的设计以及Fe3+、Cu2+的氧化能力大小的比较,能正确掌握二氧化硫的性质和了解反应的先后顺序,从而确定溶液的成分为解答本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
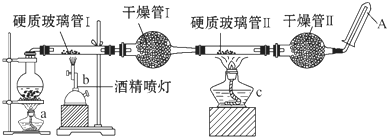 在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物
在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
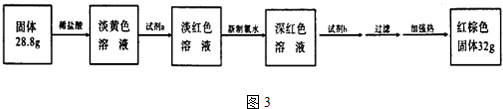
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
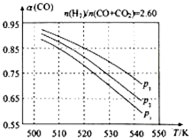 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com