

| ���� | �е�/�� | �۵�/�� | �ܶȣ�20�棩/g•cm-3 | �ܽ��� |
| �״� | 64.7 | / | 0.7915 | ������ˮ |
| ���� | 34.5 | / | 0.7138 | ����ˮ |
| 3��5-������������ | / | 33��36 | / | �����ڼ״������ѣ�����ˮ |
 ��
�� ���� �����Ǹ��ݴ��봼֮��������ѵ�ԭ�������ü���������3��5-�����������ӵ�ʵ��̽�����漰��Ӧ�����ķ�����ᴿ����Ҫ��������������Һ���������̽���˸��ݷ�Ӧԭ�����ܵõ��ĸ���Ʒ���ݴ˿�����
��1���е㲻ͬ�һ��ܵ�Һ����Բ�������ķ������룬��Һ©��ʹ��ǰҪ���м�©�������ܶȷ�����
��2��̼�������ܺ�ǿ�ᷴӦ��̼������������ˮ�У�
��3���ֲ�Ʒ���Ժ�������ˮ�����е����ѣ�����Ҫ��ˮ�����������ѣ��ɸ��ݸ�����ʵ��Ŀ�Ľ�������
��4�������������κ�һ�����ǻ�������״���Ӧ�Ļ��ᣮ
��� �⣺��1���ٸ���ͼ��֪���״������ѵ��ܻ��ܣ����е㲻ͬ�����Կ��Բ�������ķ���������״����ʴ�Ϊ������
�ڷ�Һ©����ʹ��ǰҪ���м�©������Һ©����©ʱ����ʹ�ã������ܶ�֪���л�����ܶ�С��ˮ�������Ϸ����ʴ�Ϊ���ϣ�
��2����Ϊ������к����Ȼ��⣬�Ȼ����ܺ�̼�����Ʒ�Ӧ������Ϊ��ȥ�Ȼ����ñ���NaHCO3 ��Һϴ�ӣ�̼������������ˮ��Ϊ��ȥʣ���̼�������ñ���ʳ��ˮϴ���Ҳ����ٲ������ʧ��
�ʴ�Ϊ����ȥHCl����ȥ����NaHCO3�Ҽ��ٲ�����ʧ��
��3��ϴ����ɺ�Ϊ��ȥˮ�֣�����ˮ�Ȼ��Ƹ��Ȼ����˳�ȥ��������ٸ��ݷе㲻ͬ��������ķ�����ȥ���ѣ�����������ؽᾧ�ķ����Ƶýϴ��������������˳��Ϊ��dcab��
�ʴ�Ϊ��dcab��
��4���������ӿ���ֻ��һ�����ǻ���״���Ӧ��Ҳ�����������ǻ�ȫ����״���Ӧ�����ò���Ľṹ��ʽΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼�����л���ķ�����ᴿ�����ڼ�ѹ����Ӵ����٣�ѧ���о����ѣ�Ϊѧϰ�ѵ㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ƶ� | B�� | �����ƶ� | C�� | �ﵽƽ�� | D�� | ��һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ������ | |
| 1�����ĥ������Ƭ�м���ϡ���� | |
| 2�����ĥ������Ƭ�м���Na0H��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ʊ��屽��ʵ��װ����ͼ��ʾ���ش��������⣺
�Ʊ��屽��ʵ��װ����ͼ��ʾ���ش��������⣺ ������Ϊ��װ���п��Լ��뱽��CCl4Һ�壮
������Ϊ��װ���п��Լ��뱽��CCl4Һ�壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
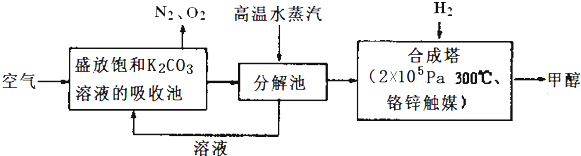
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H2O2�ֽ�����У�Fe2+�Ƿ�Ӧ�Ĵ��� | |
| B�� | ��H2O2���������У�Ҫ�ϸ������� Fe2+ | |
| C�� | H2O2�������Ա�Fe3+ǿ����ԭ�Ա�Fe2+ǿ | |
| D�� | ��H2O2�ֽ�����У���Һ��pH���½� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com