
 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等. Mg2FeH6+Mg.
Mg2FeH6+Mg. 分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;
(2)C、N、O三种元素的非金属性依次增强,电负性依次增大;1mol{Fe[CO(NH2)2]6}Cl3配合物中π键数目为1mol,σ键数目为8mol,据此进行分析;
(3)a.互为等电子体的物质结构相似;
b.同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
c.只含非极性键的分子为非极性分子,若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子;
d.分子间含有氢键的沸点较高;
(4)该晶胞中Ni原子个数=6×$\frac{1}{2}$=3,Fe原子个数=8×$\frac{1}{8}$=1,C原子个数=1,据此确定化学式;
(5)根据Mg2FeH6可由Mg和Fe的粉末为原料在氢气气氛中反应加热球磨制得,第一步反应为Mg+H2═MgH2,从组成上判断第二步反应的化学方程式.
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,
故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)同周期自左而右电负性增大,故电负性:O>N>C;1mol{Fe[CO(NH2)2]6}Cl3配合物中π键数目为1mol,σ键数目为8mol,故配合物中π键和σ键的个数比为1:8,
故答案为:O>N>C;1:8;
(3)a.已知N2O与CO2互为等电子体,等电子体的结构相似,已知CO2为直线形的分子,所以N2O的空间构型为直线形,故a正确;
b.C、N元素处于同一周期,且原子序数依次增大,但N元素处于第VA族,所以第一电离能顺序为N>C,故b错误;
c.CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,N2中只含非极性键,属于非极性分子,故c正确;
d.N2H4分子间可形成氢键,而C2H4分子间不能形成氢键,分子间含有氢键的沸点较高,而不是主要是因为C2H4相对分子质量小,故d错误,
故答案为:a、c;
(4)该晶胞中Ni原子个数=6×$\frac{1}{2}$=3,Fe原子个数=8×$\frac{1}{8}$=1,C原子个数=1,故化学式为FeNi3C,
故答案为:FeNi3C;
(5)根据Mg2FeH6可由Mg和Fe的粉末为原料在氢气气氛中反应加热球磨制得,第一步反应为Mg+H2═MgH2,从组成上判断还缺铁,故反应方程式为3MgH2+Fe Mg2FeH6+Mg,
Mg2FeH6+Mg,
故答案为:3MgH2+Fe Mg2FeH6+Mg.
Mg2FeH6+Mg.
点评 本题考查基态核外电子排布式书写,电负性比较,晶胞化学式的确定及晶体熔沸点大小比较,侧重考查学生空间想象能力及计算能力,本题难度中等.


科目:高中化学 来源: 题型:解答题
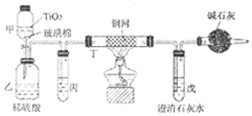
 .
.| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 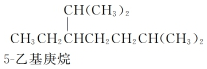 的名称为2,6二甲基5乙基庚烷 的名称为2,6二甲基5乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 化合物  是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
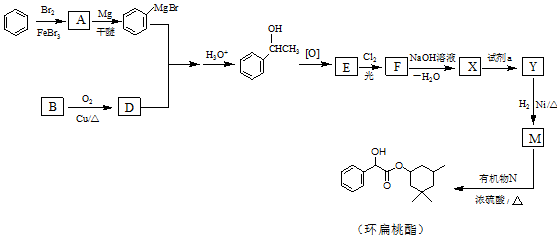
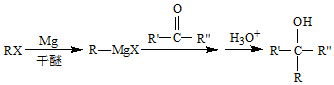 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)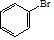 .
.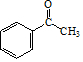 .
.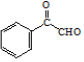 .
.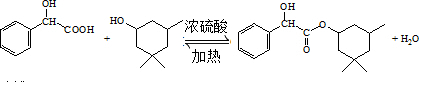 .
.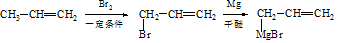
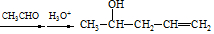
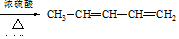 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
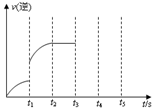 一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$
一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸分子的结构式: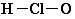 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: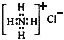 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是: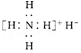 | |
| C. | 与水反应时,氢化铵被氧化 | |
| D. | 固体投入少量的水中,有两种气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2 | B. | CaC2 | C. | BaO2 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 | |
| D. | MgF2晶体中的化学键是共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com