
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.能自发进行的化学反应,一定是△H<0、△S>0
C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠
D.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3 、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:实验题
(15分)三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

⑴氯化水解法生产三氯氧磷的化学方程式为 。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是 。
②下图是不同条件对磷的沉淀回收率的影响图像。

处理该厂废水最合适的工艺条件为 (选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)= mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.HClO的电子式: B.硫离子结构示意图:
B.硫离子结构示意图:
C.丙醛的结构简式:CH3CH2COH D.碳酸的电离方程式:H2CO3 2H++CO32-
2H++CO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省2013-2014学年高三模拟考试化学试卷(解析版) 题型:实验题
(12分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
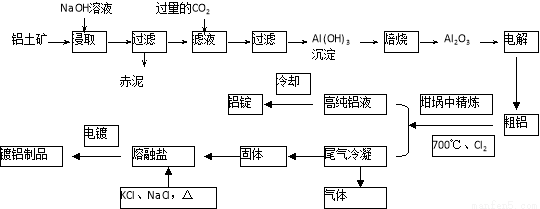
(1)向滤液中通入过量CO2所发生反应的离子方程式为 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省2013-2014学年高三模拟考试化学试卷(解析版) 题型:选择题
下图为A、B两种物质间的转化关系(其中C、D是反应物,部分产物已省略)。

以下判断不正确的是
A.若A是AlCl3,则C既可以是强碱,也可以是弱碱
B.若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应
C.上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物
D.若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南京市高一下学期期末学情调研测试化学试卷(解析版) 题型:填空题
(10分)在下图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体。

完成下列问题:
(1)写出A的化学式 。
(2)组成F的元素在周期表中位于 周期 族。
(3)B的电子式是 。
(4)反应①的化学方程式: 。
(5)反应②的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南京市高一下学期期末学情调研测试化学试卷(解析版) 题型:选择题
下列关于化学反应与能量的说法正确的是
A.中和反应是吸热反应
B.燃烧是放热反应
C.化学键断裂放出能量
D.反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏宿迁市高一下学期期末测试化学试卷(解析版) 题型:填空题
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是 物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com